Étude de la vitamine C contenue dans les kiwis, sujet de métropole, mars 2023, exercice 1
Énoncé
Exercice sur 9 points
L'acide ascorbique, couramment appelé « vitamine C », intervient dans de nombreux processus métaboliques dans le corps humain. Comme l'organisme ne peut ni la synthétiser ni la stocker, les apports en vitamine C doivent se faire par l'alimentation.
Les kiwis jaunes et les kiwis verts font partie des fruits les plus riches en acide ascorbique. L'Agence nationale de sécurité sanitaire de l'alimentation recommande un apport minimum en vitamine C de 110 mg par jour pour un adulte.
L'objectif de cet exercice est d'étudier les propriétés de l'acide ascorbique et de déterminer la quantité de kiwis nécessaire aux besoins journaliers d'un adulte en vitamine C.
Les kiwis jaunes et les kiwis verts font partie des fruits les plus riches en acide ascorbique. L'Agence nationale de sécurité sanitaire de l'alimentation recommande un apport minimum en vitamine C de 110 mg par jour pour un adulte.
L'objectif de cet exercice est d'étudier les propriétés de l'acide ascorbique et de déterminer la quantité de kiwis nécessaire aux besoins journaliers d'un adulte en vitamine C.
 Shutterstock/© AleksandraN |
Données :
• formule brute de l'acide ascorbique : C6H8O6 ;
• formule topologique de l'acide ascorbique (ci-dessous) ;
• masse molaire de l'acide ascorbique : M = 176 g·mol−1 ;
• couple acide/base associé à l'acide ascorbique : 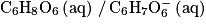 ;
;
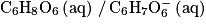 ;
;• concentration standard : c° = 1 mol·L−1 ;
 |
• données de spectroscopie infrarouge :
| Liaison | O−H | C−H | C=C | C=O |
| Nombre d'ondes (en cm−1) | 3 200 − 3 700 | 2 850 − 3 100 | 1 620 − 1 680 | 1 650 − 1 730 |
| Allure de la bande caractéristique | Forte et large | Forte | Faible et fine | Forte et fine |
1. Quelques propriétés de l'acide ascorbique
Q1. Représenter la formule semi-développée de l'acide ascorbique puis nommer les familles fonctionnelles associées aux groupes A et B entourés sur la formule topologique.
Observez la représentation de la molécule. Chaque groupe entouré appartient à une famille fonctionnelle différente. Attention à ne pas les assimiler aux groupes fonctionnels.
Q2. Justifier que le spectre infrarouge de la figure 1 est compatible avec la structure de l'acide ascorbique.
Les groupes fonctionnels de l'acide ascorbique donnent des bandes caractéristiques particulières dans le spectre infrarouge donné.
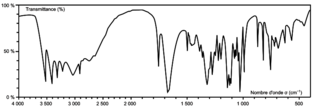 Figure 1. Spectre infrarouge de l'acide ascorbique |
Pour étudier les propriétés acido-basiques de la vitamine C, on dissout 1 g d'acide ascorbique commercial dans une fiole jaugée de 50 mL puis on complète jusqu'au trait de jauge avec de l'eau distillée. La mesure du pH de la solution donne pH = 2,6.
Q3. Déterminer la quantité de matière initiale n0 d'acide ascorbique introduite dans la fiole jaugée.
Utilisez la relation donnant la quantité de matière en fonction de la masse et de la masse molaire moléculaire.
La transformation entre l'acide ascorbique et l'eau est modélisée par la réaction d'équation :
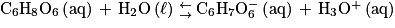
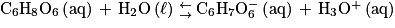
Q4. Donner la définition d'un acide faible.
C'est la définition au sens d'acide de Bronsted.
Q5. Montrer que l'acide ascorbique est un acide faible dans l'eau.
Raisonnez par l'absurde : si l'acide ascorbique était un acide fort, une solution d'acide ascorbique aurait un pH particulier. Pour cela, il faut au préalable calculer la concentration de l'acide ascorbique.
Q6. Donner l'expression de la constante d'acidité KA du couple associé à l'acide ascorbique en fonction des concentrations ![\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6} \right ]](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m3.png) ,
, ![\left [ \mathrm{C}_{6}\mathrm{H}_{7}\mathrm{O}_{6}^{-} \right ]](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m4.png) ,
, ![\left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m5.png) à l'équilibre et de la concentration standard c°, puis montrer que la valeur du pKA est proche de 4,2.
à l'équilibre et de la concentration standard c°, puis montrer que la valeur du pKA est proche de 4,2.
![\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6} \right ]](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m3.png) ,
, ![\left [ \mathrm{C}_{6}\mathrm{H}_{7}\mathrm{O}_{6}^{-} \right ]](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m4.png) ,
, ![\left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m5.png) à l'équilibre et de la concentration standard c°, puis montrer que la valeur du pKA est proche de 4,2.
à l'équilibre et de la concentration standard c°, puis montrer que la valeur du pKA est proche de 4,2.La constante d'acidité KA est celle associée à la transformation chimique modélisée par la réaction donnée. On sait que pKA = −log (KA). Utilisez les propriétés mathématiques de la fonction logarithme.
2. Acide ascorbique dans un kiwi jaune
Pour déterminer la concentration en acide ascorbique d'un kiwi jaune, on le mixe jusqu'à en obtenir du jus dont le pH est de 3,5.
Q7. Déterminer l'espèce acide-base prédominante associée à l'acide ascorbique présente dans le jus d'un kiwi jaune.
Déterminez le diagramme de prédominance du couple acide ascorbique/ion ascorbate.
La quantité d'acide ascorbique présente dans un kiwi jaune est déterminée à l'aide d'un dosage par excès. Le principe de ce dosage est le suivant :
• on met le jus de kiwi en présence d'une quantité connue de diiode I2. Seul l'acide ascorbique réagit avec le diiode, introduit en excès ;
• on détermine ensuite par titrage la quantité de diiode restant ;
• on en déduit alors la quantité d'acide ascorbique dans le kiwi jaune.
Protocole du dosage
• Étape 1 : réaction de l'acide ascorbique avec le diiode :
Introduire la totalité du jus d'un kiwi jaune mixé dans une fiole jaugée de 250 mL, puis compléter avec de l'eau distillée jusqu'au trait de jauge. On appelle S la solution ainsi obtenue.
Introduire dans un erlenmeyer un volume V = 50 mL de la solution S, ainsi qu'un volume V1 = 20 mL d'une solution aqueuse de diiode I2 à la concentration C1 = 2,9 × 10−2 mol·L−1.
Cette transformation peut être modélisée par la réaction de l'équation suivante :
C6H8O6(aq) + I2(aq) → C6H6O6(aq) + 2 I−(aq)+ 2 H+(aq)
Introduire la totalité du jus d'un kiwi jaune mixé dans une fiole jaugée de 250 mL, puis compléter avec de l'eau distillée jusqu'au trait de jauge. On appelle S la solution ainsi obtenue.
Introduire dans un erlenmeyer un volume V = 50 mL de la solution S, ainsi qu'un volume V1 = 20 mL d'une solution aqueuse de diiode I2 à la concentration C1 = 2,9 × 10−2 mol·L−1.
Cette transformation peut être modélisée par la réaction de l'équation suivante :
C6H8O6(aq) + I2(aq) → C6H6O6(aq) + 2 I−(aq)+ 2 H+(aq)
• Étape 2 : titrage du diiode restant par les ions thiosulfate 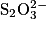 :
:
Titrer le contenu de l'erlenmeyer préparé lors de l'étape 1 par une solution aqueuse de thiosulfate de sodium de concentration C2 = 5 × 10–2 mol·L–1, en présence d'un indicateur coloré spécifique au diiode.
On obtient un volume à l'équivalence V2 = 16,5 mL.
La transformation mise en jeu lors du titrage peut être modélisée par la réaction d'équation suivante :
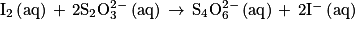
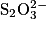 :
:Titrer le contenu de l'erlenmeyer préparé lors de l'étape 1 par une solution aqueuse de thiosulfate de sodium de concentration C2 = 5 × 10–2 mol·L–1, en présence d'un indicateur coloré spécifique au diiode.
On obtient un volume à l'équivalence V2 = 16,5 mL.
La transformation mise en jeu lors du titrage peut être modélisée par la réaction d'équation suivante :
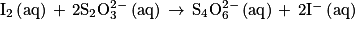
Q8. En exploitant le résultat du titrage, montrer que la quantité de matière de diiode dosé lors de l'étape 2 est égale à 4,13 × 10−4 mol.
À l'équivalence d'un titrage, le réactif titré et le réactif titrant ont été introduits dans les proportions stœchiométriques de l'équation de titrage.
Q9. Après avoir calculé la masse d'acide ascorbique contenue dans un kiwi jaune, déterminer combien il faudrait en manger pour satisfaire les besoins journaliers en acide ascorbique d'un adulte.
Il faut d'abord déterminer la quantité d'acide ascorbique dans un kiwi jaune. Puis il faut la comparer à la DJA en acide ascorbique pour un adulte.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n'a pas abouti. La démarche est évaluée et doit être correctement présentée.
Le même dosage est réalisé avec un kiwi vert de même masse. On obtient un nouveau volume à l'équivalence pour le titrage du diiode restant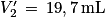 .
.
Le même dosage est réalisé avec un kiwi vert de même masse. On obtient un nouveau volume à l'équivalence pour le titrage du diiode restant
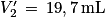 .
.Q10. Expliquer sans calcul si le kiwi vert contient plus ou moins d'acide ascorbique que le kiwi jaune.
On réalise un titrage indirect de la quantité de diiode qui n'a pas réagi avec l'acide ascorbique.
3. Oxydation de l'acide ascorbique par le bleu de méthylène
L'acide ascorbique est un réducteur, ce qui conditionne sa conservation à l'air libre. Dans cette partie, pour des raisons pratiques, on étudie ses propriétés réductrices en le faisant réagir avec du bleu de méthylène.Au contact du bleu de méthylène, noté BM+, l'acide ascorbique C6H8O6 contenu dans le jus de kiwi se transforme en un nouveau composé de formule brute C6H6O6.
Données :
• couple oxydant/réducteur associé à l'acide ascorbique : C6H6O6(aq)/C6H8O6(aq) ;
• couple oxydant/réducteur associé au bleu de méthylène : BM+(aq)/BMH(aq).
Q11. À l'aide des demi-équations électroniques de chacun des couples mis en jeu, établir l'équation de la réaction modélisant la transformation chimique ayant lieu entre l'acide ascorbique C6H8O6 et le bleu de méthylène BM+.
Les demi-équations électroniques sont écrites pour chaque couple d'oxydoréduction. Puis on combine les deux pour obtenir l'équation de la réaction modélisant la transformation chimique.
On réalise le suivi cinétique de cette réaction à deux températures différentes. Après traitement des résultats, on trace sur la figure 2 l'évolution temporelle de la concentration CASC de l'acide ascorbique, pour les deux températures choisies.
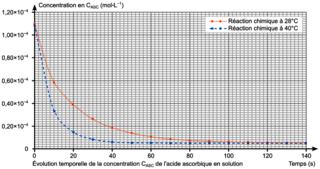 Figure 2. Évolution temporelle de la concentration CASC de l'acide ascorbique en solution |
Q12. Exprimer la vitesse volumique de disparition de l'acide ascorbique en fonction de CASC puis déterminer sa valeur à l'instant initial à la température de 28 °C.
La définition de la vitesse volumique représente l'opposé du coefficient directeur de la tangente à la courbe donnant l'évolution de la concentration en réactif au cours du temps.
Q13. En utilisant les courbes de la figure 2, identifier en justifiant deux facteurs cinétiques de la réaction entre l'acide ascorbique et le bleu de méthylène.
Les deux facteurs cinétiques sont liés aux deux courbes d'une part et à l'évolution de la courbe.
Corrigé
1. Quelques propriétés de l'acide ascorbique
Q1. L'acide ascorbique :
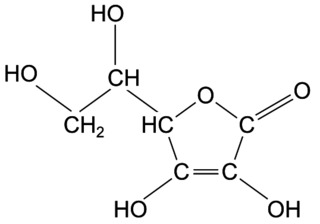 |
Le groupe A appartient à la famille des alcools.
Le groupe B appartient à la famille des esters.
Le groupe B appartient à la famille des esters.
Q2. Le spectre IR de la figure donné est compatible avec la structure de la vitamine C, car il comporte :
• une bande d'absorption forte et large autour de 3 400 cm–1 pour les liaisons O–H ;
• une bande d'absorption forte et fine autour de 1 700 cm–1 pour la liaison C=O ;
• une bande d'absorption forte autour de 3 000 cm–1 pour les liaisons C–H.
Q3. Quantité de matière dissoute : 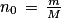 soit
soit 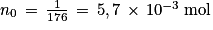 .
.
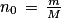 soit
soit 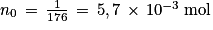 .
.Q4. Un acide faible est une espèce chimique qui ne réagit pas totalement avec l'eau.
Q5. La concentration d'acide ascorbique est 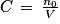 , d'où
, d'où 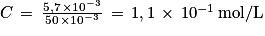 .
.
Si l'acide ascorbique était un acide fort, alors la réaction avec l'eau serait totale et le pH de la solution serait pH = −log C. Numériquement on trouve pH = 0,94.
Or le pH mesuré est de 2,6, ce qui infirme l'hypothèse. Donc l'acide ascorbique est un acide faible.
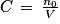 , d'où
, d'où 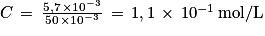 .
.Si l'acide ascorbique était un acide fort, alors la réaction avec l'eau serait totale et le pH de la solution serait pH = −log C. Numériquement on trouve pH = 0,94.
Or le pH mesuré est de 2,6, ce qui infirme l'hypothèse. Donc l'acide ascorbique est un acide faible.
Q6. D'après la réaction : ![K_{A}\, = \, \frac{\left [ \mathrm{C}_{6}\mathrm{H}_{7}\mathrm{O}_{6}^{-} \right ]\, \times \, \left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]}{\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6} \right ]\, \times \, \mathrm{C}^{0}}](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m13.png)
Soit![-\mathrm{log}\left ( K_{A} \right )\, = \, -\mathrm{log}\left ( \frac{\left [ \mathrm{C}_{6}\mathrm{H}_{7}\mathrm{O}_{6}^{-} \right ]\, \times \, \left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]}{\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6} \right ]\, \times \, \mathrm{C}^{0}} \right )](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m14.png)
D'où![pK_{A}\, = \, -\mathrm{log}\left ( \frac{\left [ \mathrm{C}_{6}\mathrm{H}_{7}\mathrm{O}_{6}^{-} \right ]}{\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6} \right ]} \right )\, -\mathrm{log}\frac{\left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]}{\mathrm{C^{0}}}](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m15.png)
Soit![pK_{A}\, = \, -\mathrm{log}\left ( \frac{\left [ \mathrm{C}_{6}\mathrm{H}_{7}\mathrm{O}_{6}^{-} \right ]}{\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6} \right ]} \right )\, +\, pH](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m16.png) .
.
Or d'après la stœchiométrie de la réaction![\left [ \mathrm{C}_{6}\mathrm{H}_{7}\mathrm{O}_{6}^{-} \right ]\, = \, \left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]\, = \, \mathrm{C}^{0}\, \times \, 10^{-\mathrm{pH}}](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m17.png)
![\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6} \right ]\, = \, \mathrm{C}\, -\, \mathrm{C}^{0}\, \times \, 10^{-\mathrm{pH}}](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m18.png) .
.
D'où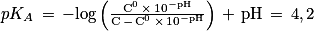 .
.
![K_{A}\, = \, \frac{\left [ \mathrm{C}_{6}\mathrm{H}_{7}\mathrm{O}_{6}^{-} \right ]\, \times \, \left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]}{\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6} \right ]\, \times \, \mathrm{C}^{0}}](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m13.png)
Soit
![-\mathrm{log}\left ( K_{A} \right )\, = \, -\mathrm{log}\left ( \frac{\left [ \mathrm{C}_{6}\mathrm{H}_{7}\mathrm{O}_{6}^{-} \right ]\, \times \, \left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]}{\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6} \right ]\, \times \, \mathrm{C}^{0}} \right )](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m14.png)
D'où
![pK_{A}\, = \, -\mathrm{log}\left ( \frac{\left [ \mathrm{C}_{6}\mathrm{H}_{7}\mathrm{O}_{6}^{-} \right ]}{\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6} \right ]} \right )\, -\mathrm{log}\frac{\left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]}{\mathrm{C^{0}}}](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m15.png)
Soit
![pK_{A}\, = \, -\mathrm{log}\left ( \frac{\left [ \mathrm{C}_{6}\mathrm{H}_{7}\mathrm{O}_{6}^{-} \right ]}{\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6} \right ]} \right )\, +\, pH](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m16.png) .
.Or d'après la stœchiométrie de la réaction
![\left [ \mathrm{C}_{6}\mathrm{H}_{7}\mathrm{O}_{6}^{-} \right ]\, = \, \left [ \mathrm{H}_{3}\mathrm{O}^{+} \right ]\, = \, \mathrm{C}^{0}\, \times \, 10^{-\mathrm{pH}}](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m17.png)
![\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6} \right ]\, = \, \mathrm{C}\, -\, \mathrm{C}^{0}\, \times \, 10^{-\mathrm{pH}}](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m18.png) .
.D'où
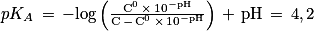 .
.2. Acide ascorbique dans un kiwi jaune
Q7. Domaine de prédominance :
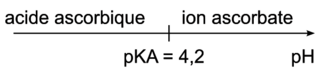 |
D'où à pH = 3,5 on est dans le domaine de prédominance de l'acide ascorbique.
Q8. À l'équivalence d'un titrage, le réactif titré et le réactif titrant ont été introduits dans les proportions stœchiométriques de l'équation de titrage.
D'après la stœchiométrie de la réaction on a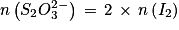 .
.
Soit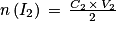 . Numériquement
. Numériquement 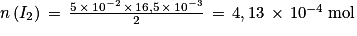 .
.
D'après la stœchiométrie de la réaction on a
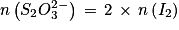 .
.Soit
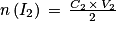 . Numériquement
. Numériquement 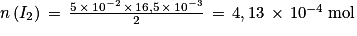 .
.Q9. La quantité de diiode initialement introduite est n(I2)initiale = C1 × V1 = 5,8 × 10−4 mol.
À la question 8, on a déterminé la quantité de diiode restant donc la quantité de diiode qui a réagi :
n(I2)réagi = n(I2)initiale − n(I2), soit n(I2)réagi = 5,8 × 10−4 − 4,13 × 10–4 = 1,7 × 10−4 mol.
D'après la stœchiométrie de l'équation de la réaction de l'étape 1, on aura n(I2)réagi = n(C6H8O6) = 1,7 × 10−4 mol dans le volume V = 50 mL de solution S.
Dans 250 mL, on aura 5 fois plus d'acide ascorbique : n(C6H8O6) = 1,7 × 10−4 × 5 = 8,4 × 10–4 mol.
C'est la quantité dans un kiwi, soit une masse m = n × M = 8,4 × 10−4 × 176 = 1,5 × 10−1 g.
On est au-dessus de l'apport minimum recommandé en acide ascorbique avec un kiwi, un seul kiwi jaune suffit.
À la question 8, on a déterminé la quantité de diiode restant donc la quantité de diiode qui a réagi :
n(I2)réagi = n(I2)initiale − n(I2), soit n(I2)réagi = 5,8 × 10−4 − 4,13 × 10–4 = 1,7 × 10−4 mol.
D'après la stœchiométrie de l'équation de la réaction de l'étape 1, on aura n(I2)réagi = n(C6H8O6) = 1,7 × 10−4 mol dans le volume V = 50 mL de solution S.
Dans 250 mL, on aura 5 fois plus d'acide ascorbique : n(C6H8O6) = 1,7 × 10−4 × 5 = 8,4 × 10–4 mol.
C'est la quantité dans un kiwi, soit une masse m = n × M = 8,4 × 10−4 × 176 = 1,5 × 10−1 g.
On est au-dessus de l'apport minimum recommandé en acide ascorbique avec un kiwi, un seul kiwi jaune suffit.
Q10. Dans un kiwi vert, le volume à l'équivalence étant plus grand, la quantité de diiode restant après l'étape 2 est donc plus grande. Il y aura moins de diiodes qui auront réagi avec l'acide ascorbique du kiwi, il contient donc moins d'acide ascorbique qu'un kiwi jaune.
3. Oxydation de l'acide ascorbique par le bleu de méthylène
Q11. Oxydoréduction :
C6H8O6 (aq) = C6H6O6(aq) + 2H+ + 2e−
Et BM+(aq) + H+ + 2e− = BMH(aq)
Soit C6H8O6(aq) + BM+(aq) → C6H6O6(aq) + H+ + BMH(aq)
C6H8O6 (aq) = C6H6O6(aq) + 2H+ + 2e−
Et BM+(aq) + H+ + 2e− = BMH(aq)
Soit C6H8O6(aq) + BM+(aq) → C6H6O6(aq) + H+ + BMH(aq)
Q12. La vitesse volumique de disparition de l'acide ascorbique est par définition : ![v\, = \, -\frac{d\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6}\left ( \mathrm{aq} \right ) \right ]}{dt}](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m23.png) .
.
![v\, = \, -\frac{d\left [ \mathrm{C}_{6}\mathrm{H}_{8}\mathrm{O}_{6}\left ( \mathrm{aq} \right ) \right ]}{dt}](https://static1.assistancescolaire.com/t/images/t_speph_rde30_m23.png) .
.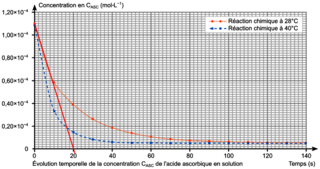 |
On peut donc écrire entre l'instant initial et t = 20 s : 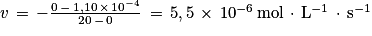 .
.
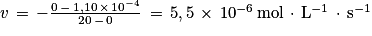 .
.Q13. Comme la vitesse de disparition de l'acide ascorbique est plus grande à 40 °C qu'à 28 °C, la température est un facteur cinétique, on peut également citer comme autre facteur cinétique la concentration des réactifs, car au fur et à mesure que les réactifs sont consommés, leur concentration diminue et donc la vitesse volumique de disparition diminue.

