Énoncé
Exercice sur 5 points
L'arôme de banane est un mélange complexe de plusieurs espèces chimiques naturelles. Le principal constituant de cet arôme est l'éthanoate de 3-méthylbutyle, aussi appelé « acétate d'isoamyle » : il est utilisé en parfumerie et comme additif alimentaire.
L'objectif de cet exercice est de comparer plusieurs protocoles permettant de synthétiser au laboratoire cette espèce chimique, afin de déterminer quelle synthèse est la plus écoresponsable.
L'équation de la réaction de synthèse de l'éthanoate de 3-méthylbutyle est la suivante :
L'objectif de cet exercice est de comparer plusieurs protocoles permettant de synthétiser au laboratoire cette espèce chimique, afin de déterminer quelle synthèse est la plus écoresponsable.
L'équation de la réaction de synthèse de l'éthanoate de 3-méthylbutyle est la suivante :
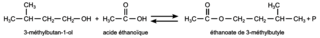 |
Données :
• table de données de spectroscopie infrarouge :
| Liaison | O–H | C–H | C=C | C=O |
| Nombre d'ondes (en cm−1) | 3200 – 3700 | 2850 – 3100 | 1620 – 1680 | 1650 – 1750 |
| Allure de la bande caractéristique | Forte et large | Forte | Faible et fine | Forte et fine |
1. Identification des espèces mises en jeu dans la réaction
Q1. Représenter la formule topologique des réactifs et de l'éthanoate de 3-méthybutyle. Entourer les groupes caractéristiques et identifier les familles fonctionnelles correspondantes.
Il faut traiter les deux réactifs et l'éthanoate de 3-méthylbutyle. La formule topologique est une représentation simplifiée des molécules dans laquelle les atomes de carbone et les atomes d'hydrogène liés aux atomes de carbone ne sont pas représentés.
Q2. Justifier que le produit P obtenu lors de cette synthèse est de l'eau.
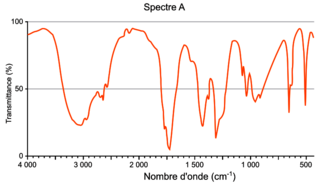
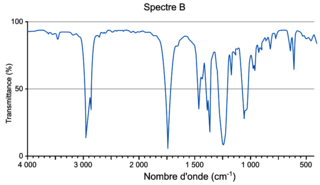
Q3. Attribuer, à l'aide des données et en justifiant, chacun des spectres A et B représentés ci-après soit à l'acide éthanoïque, soit à l'éthanoate de 3-méthylbutyle.
Il faut déterminer les spectres qui sont remarquables dans chaque famille.
 |
 Source : https://sdbs.db.aist.go.jp/ |
2. Comparaison de protocoles de synthèse
Données :
• l'ion hydrogénocarbonate \mathrm{HCO}_{3}^{-} est une espèce amphotère appartenant aux couples acide/base suivants : \mathrm{HCO}_{3}^{-}\left ( \mathrm{aq} \right )/\mathrm{CO}_{3}^{2-}\left ( \mathrm{aq} \right ) et \left ( \mathrm{CO}_{2}\left ( \mathrm{g} \right )/\mathrm{H}_{2}\mathrm{O}\left ( \mathrm{l} \right ) \right )/\mathrm{HCO}_{3}^{-}\left ( \mathrm{aq} \right ) ;
• données physico-chimiques à 20 °C et données de sécurité :
| Espèce chimique | Masse molaire en \mathrm{g\, \cdot \, mol}^{-1} | Densité | Solubilité dans l'eau salée | Pictogrammes de sécurité | |
| 3-méthylbutan-1-ol | 88,2 | 0,81 | Peu soluble |
| |
| |||||
| Acide éthanoïque | 60,0 | 1,05 | Très soluble |
| |
| |||||
| Éthanoate de 3-méthylbutyle | 130,2 | 0,87 | Très peu soluble |
| |
| Cyclohexane | 84,2 | 0,78 | Insoluble |
| |
| |||||
| |||||
|
Dans la suite de l'exercice, on compare trois protocoles de synthèse.
Protocole A : synthèse avec montage de chauffage à reflux.
Protocole A : synthèse avec montage de chauffage à reflux.
- Étape 1 : dans un ballon, on introduit 22 mL de 3-méthylbutan-1-ol, 15 mL d'acide éthanoïque pur et 10 gouttes d'acide sulfurique concentré, ainsi que quelques grains de pierre ponce.
- Étape 2 : le mélange est chauffé à reflux pendant 45 minutes, puis refroidi à la température ambiante.
- Étape 3 : la phase organique est ensuite lavée avec une solution aqueuse saturée de chlorure de sodium, puis avec une solution aqueuse d'hydrogénocarbonate de sodium. La phase organique est alors séchée à l'aide de sulfate de magnésium anhydre.
- La masse d'éthanoate de 3-méthylbutyle obtenue est mB = 19,7 g.
Q4. Nommer les étapes 2 et 3 du protocole A.
L’acide sulfurique concentré est utilisé comme catalyseur dans ce protocole.
L’acide sulfurique concentré est utilisé comme catalyseur dans ce protocole.
L’éthanoate de 3-méthylbutyle est très peu soluble dans l’eau salée, donc il est extrait de cette phase aqueuse. On réalise une deuxième opération avec du sulfate de magnésium qui est un desséchant.
Q5. Préciser le sens du mot « catalyseur ».
Un catalyseur est une espèce chimique qui n’intervient pas dans le bilan de la réaction.
Q6. Préciser l’utilité du montage de chauffage à reflux dans ce protocole.
Lors d’un chauffage à reflux, les réactifs et produits formés retombent dans le ballon.
Lors du second lavage de l’étape 3 du protocole, on observe un dégagement gazeux.
Lors du second lavage de l’étape 3 du protocole, on observe un dégagement gazeux.
Q7. À l’aide des données, proposer une explication à cette observation et justifier l’utilité de cette étape.
Étudiez le caractère acido-basique du mélange et le domaine de prédominance du couple acide/base : \left ( \textrm{CO}_{2} \left ( \textrm{g} \right )\: /\: \textrm{H}_{2}\textrm{O}\left ( \textrm{l} \right )\right )/\textrm{HCO}_{3}^{-}\left ( \textrm{aq} \right ).
Q8. Déterminer le réactif limitant utilisé dans le protocole A puis calculer le rendement de la synthèse réalisée en suivant ce protocole.
Avec le protocole expérimental donné, déterminez les quantités de matière des réactifs. Une fois le réactif limitant déterminé, en déduire le rendement avec la définition de celui-ci.
Dans les protocoles B et C, les étapes 1 et 3 sont identiques à celles du protocole A mais l’étape 2 est modifiée comme indiqué ci-dessous :
Le chauffe-ballon utilisé dans les protocoles A et C lors de l’étape 2 consomme une énergie de 4,1 × 105 J.
| | Protocole B | Protocole C |
|---|---|---|
| | Synthèse au four à micro-ondes | Synthèse avec un appareil de Dean-Stark |
| Modifications de l’étape 2 | Chauffage avec une puissance de 800 W pendant 30 s. | Chauffage à l’aide de l’appareil Dean-Stark permettant d’extraire l’eau au cours de sa formation, en présence de cyclohexane jouant le rôle de solvant. |
| Rendement | 87 % | 85 % |
Le chauffe-ballon utilisé dans les protocoles A et C lors de l’étape 2 consomme une énergie de 4,1 × 105 J.
Q9. Calculer l’énergie utilisée pour chauffer le mélange réactionnel dans le protocole B. Commenter.
Il s’agit de comparer la consommation d’énergie électrique selon les trois protocoles.
« L’objectif de la chimie verte est de réduire l’impact de la chimie sur la santé humaine et l’environnement. Il s’agit donc de rechercher des milieux réactionnels alternatifs et respectueux de l’environnement tout en s’efforçant, dans le même temps, d’augmenter les vitesses et d’abaisser les températures de réaction. Paul T. Anastas et John C. Warner ont développé 12 principes de la chimie verte en 1991. Ces principes se divisent en deux groupes : « réduire le risque » et « réduire le plus possible l’empreinte environnementale ». »
D’après https://www.sigmaaldrich.com/
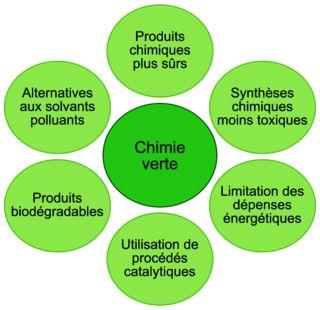 Figure 1. Schéma illustrant quelques principes directeurs de la chimie verte |
Q10. À l’aide de la figure 1, identifier, en le justifiant, quel protocole répond le mieux aux principes directeurs de la chimie verte.
Regardez le coup en énergie de chaque protocole et les solvants utilisés.
Corrigé
Q1. Formule topologique des réactifs et de l’éthanoate de 3-méthylbutyle :
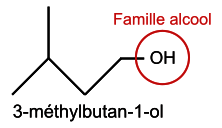 |
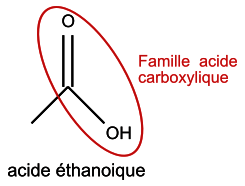 |
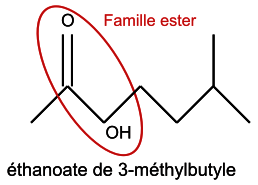 |
Q2. En formule brute, on a :
\textrm{C}_{5}\textrm{H}_{12}\: +\: \textrm{C}_{2}\textrm{H}_{4}\textrm{O}_{2}\:\rightleftharpoons\: \textrm{C}_{7}\textrm{H}_{14}\textrm{O}\: +\: \textrm{H}_{2}\textrm{O}. Pour respecter la conservation des atomes.
\textrm{C}_{5}\textrm{H}_{12}\: +\: \textrm{C}_{2}\textrm{H}_{4}\textrm{O}_{2}\:\rightleftharpoons\: \textrm{C}_{7}\textrm{H}_{14}\textrm{O}\: +\: \textrm{H}_{2}\textrm{O}. Pour respecter la conservation des atomes.
Q3. Le spectre A possède plusieurs pics caractéristiques :
• un pic fort et large autour de 3 200 cm−1 caractéristique du groupe hydroxyle OH ;
• un pic fort et fin autour de 1 700 cm−1 caractéristique du groupe carbonyle C=O.
La seule molécule ayant ces deux groupes est l'acide éthanoïque.
Le spectre B, lui, ne possède pas le pic large autour de 3 200 cm−1, caractéristique du groupe hydroxyle OH, par contre, il possède un pic fort et fin autour de 1 700 cm−1 caractéristique du groupe carbonyle C=O, il s'agit du spectre de l'éthanoate de 3-méthylbutyle.
Le spectre B, lui, ne possède pas le pic large autour de 3 200 cm−1, caractéristique du groupe hydroxyle OH, par contre, il possède un pic fort et fin autour de 1 700 cm−1 caractéristique du groupe carbonyle C=O, il s'agit du spectre de l'éthanoate de 3-méthylbutyle.
Q4. L'étape 2 correspond au chauffage à reflux des réactifs : c'est donc une transformation chimique. L'étape 3 correspond au lavage et séchage de l'ester : c'est donc l'extraction et la purification du produit.
Q5. Un catalyseur est un composé qui augmente la vitesse de synthèse d'une réaction tout en n'intervenant pas dans le bilan de celle-ci.
Q6. Le montage à reflux permet de synthétiser un composé en agissant sur la température tout en évitant les pertes de réactifs par évaporation. Ceux-ci vont se condenser grâce à la colonne et retomber dans le mélange réactionnel.
Q7. Lors de l'étape 3, on lave la phase organique avec une solution aqueuse d'hydrogénocarbonate de sodium. Or la phase organique peut contenir des traces d'acide sulfurique, qui est un catalyseur, ou d'acide éthanoïque, qui est en excès. L'ion hydrogénocarbonate se transforme alors en dioxyde de carbone qui est un gaz et qui s'échappe de la solution. Cette étape permet d'éliminer le reste éventuel d'acide qui se trouverait dans la phase organique.
Q8. Calculons la quantité de matière :
• 3-méthylbutan-1-ol : d = 0,81 soit ρ = 0,81 g/mL
m1 = ρ × V = 0,81 × 22 = 18 g
n_{1}\, =\, \frac{m_{1}}{M}\, =\,\frac{\rho \, \times V}{M}\, =\, \frac{0,81\, \times \, 22}{88,2}\, =\, 0,20\, \textrm{mol}
m1 = ρ × V = 0,81 × 22 = 18 g
n_{1}\, =\, \frac{m_{1}}{M}\, =\,\frac{\rho \, \times V}{M}\, =\, \frac{0,81\, \times \, 22}{88,2}\, =\, 0,20\, \textrm{mol}
• Acide éthanoïque : d = 1,05 soit ρ = 1,05 g/mL
m2 = ρ × V = 1,05 × 15 = 16 g
n_{2}\, =\, \frac{m_{2}}{M}\, =\,\frac{\rho \, \times V}{M}\, =\, \frac{1,05\, \times \, 15}{60,0}\, =\, 0,26\, \textrm{mol}
m2 = ρ × V = 1,05 × 15 = 16 g
n_{2}\, =\, \frac{m_{2}}{M}\, =\,\frac{\rho \, \times V}{M}\, =\, \frac{1,05\, \times \, 15}{60,0}\, =\, 0,26\, \textrm{mol}
D'après la stœchiométrie de la réaction n1 < n2, on voit donc que le 3-méthylbutan-1-ol est le réactif limitant.
Le rendement est donc \mu \, =\, \frac{n_{obtenu}}{n_{max}}
On a n_{obtenu}\, =\, \frac{m_{B}}{M_{B}}\, =\, \frac{19,7}{130,2}\, =\, 0,151\, \textrm{mol}
\mu \, =\, \frac{0,151}{0,20}\, =\, 0,75, soit 75 %.
Le rendement est donc \mu \, =\, \frac{n_{obtenu}}{n_{max}}
On a n_{obtenu}\, =\, \frac{m_{B}}{M_{B}}\, =\, \frac{19,7}{130,2}\, =\, 0,151\, \textrm{mol}
\mu \, =\, \frac{0,151}{0,20}\, =\, 0,75, soit 75 %.
Q9. L'énergie électrique utilisée est donnée par E = P × Δt où P est la puissance et Δt est la durée d'utilisation.
Donc E = 800 × 30 = 2,4 × 104 J.
Les protocoles A et C consomment près de 20 fois plus d'énergie \left ( \frac{4,1\, \times \, 10^{5}}{2,4\, \times 10^{4}}\, = \, 17 \right ). L'utilisation du protocole B permet de consommer beaucoup moins d'énergie.
Donc E = 800 × 30 = 2,4 × 104 J.
Les protocoles A et C consomment près de 20 fois plus d'énergie \left ( \frac{4,1\, \times \, 10^{5}}{2,4\, \times 10^{4}}\, = \, 17 \right ). L'utilisation du protocole B permet de consommer beaucoup moins d'énergie.
Q10. De ce fait, l'utilisation du protocole B permet de limiter les dépenses énergétiques, 17 fois moins gourmand en consommation électrique que les deux autres protocoles. Et il n'utilise pas le solvant cyclohexane du protocole C, qui, d'après les pictogrammes de sécurité du cyclohexane, montre que celui-ci est inflammable, nocif et dangereux pour l'environnement et pour la santé. Enfin, le protocole B possède un meilleur rendement. Il s'inscrit dans une chimie verte.










