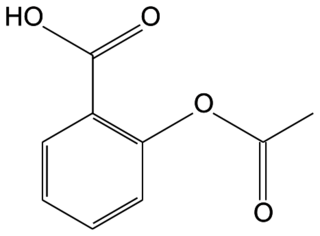
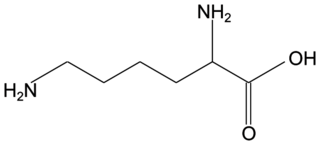
Une formulation de l'aspirine, sujet de métropole, mars 2023, exercice 3
Énoncé
Exercice sur 4 points
L’aspirine est le nom commercial de l’acide acétylsalicylique. L’aspirine est utilisée depuis le début du xxe siècle comme principe actif analgésique (antidouleur) et antipyrétique (contre la fièvre). Il s’agit encore aujourd’hui d’un des médicaments les plus consommés au monde.
Cet exercice a pour objectif d’étudier un sachet de médicament contenant de l’acide acétylsalicylique.
Cet exercice a pour objectif d’étudier un sachet de médicament contenant de l’acide acétylsalicylique.
Données :
• extrait de la notice d’un sachet de médicament contenant de l’acide acétylsalicylique :
| Utilisation : sachet dose de 1 g à dissoudre dans l’eau Principe actif : ion acétylsalicylate Composition : 900 mg d’acétylsalicylate de DL-lysine équivalent à un apport de 500 mg en acide acétylsalicylique |
• en dissolvant un sachet de médicament dans 40 mL d’eau, on obtient une solution de pH = 5 ;
• couple acide/base (acide acétylsalicylique/ion acétylsalicylate) : pKA = 3,5 à 25 °C ;
• propriétés de quelques espèces chimiques :
| | Acide acétylsalicylique | DL-lysine | ||
| Formule topologique |
|
| ||
| Formule brute | C9H8O4 | C6H14N2O2 | ||
| Masse molaire (g·mol−1) | 180,2 | 146,2 |
• diagramme de prédominance (sans souci d’échelle) de la DL-lysine :
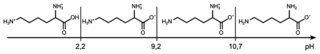 |
• cercle chromatique :
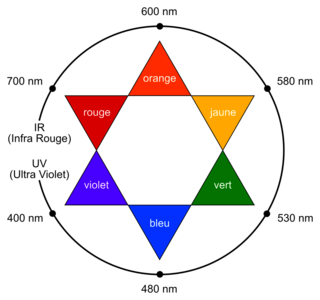 |
• pour décider si le résultat d’une mesure est en accord avec une valeur de référence, on utilise le quotient 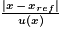 avec x, la valeur mesurée ; xref la valeur de référence et u(x), l’incertitude-type associée à la valeur mesurée x.
avec x, la valeur mesurée ; xref la valeur de référence et u(x), l’incertitude-type associée à la valeur mesurée x.
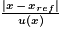 avec x, la valeur mesurée ; xref la valeur de référence et u(x), l’incertitude-type associée à la valeur mesurée x.
avec x, la valeur mesurée ; xref la valeur de référence et u(x), l’incertitude-type associée à la valeur mesurée x.Le sachet de médicament étudié contient de l’aspirine sous la forme d’un composé ionique, l’acétylsalicylate de DL-lysine.
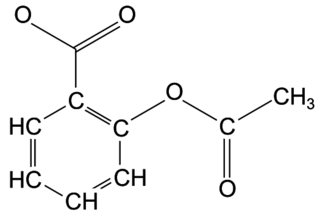
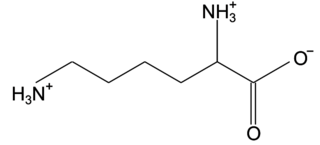
Q1. Représenter la formule semi-développée de l’ion acétylsalicylate.
L’ion acétylsalicylate est la base conjuguée de l’acide acétylsalicylique. Il a donc perdu un proton H+ par rapport à l’acide.
Q2. La DL-lysine appartient à la famille des acides aminés. Proposer une explication.
Pour faire partie des acides aminés, il faut que la molécule possède deux groupes caractéristiques particuliers.
Q3. Indiquer la forme prédominante des espèces associées à l’acide acétylsalicylique et à la DL-lysine présentes dans la solution de médicament obtenue après dissolution du contenu du sachet dans l’eau.
Réalisez un diagramme de prédominance pour le couple acide acétylsalicylique/ion acétylsalicylate. Celui de la DL-lysine étant déjà donné. Conclure.
Q4. Justifier alors que le titrage acide-base de cette solution aqueuse de médicament par une solution d’acide fort ne permet pas de déterminer directement la quantité de matière de l’ion acétylsalicylate en solution.
Faites le bilan sur les espèces basiques présentes dans la solution aqueuse de ce médicament.
On souhaite vérifier l’indication « équivalent à un apport de 500 mg en acide acétylsalicylique » figurant sur la notice du médicament. Pour cela, on réalise le protocole suivant :
Les nombres stœchiométriques associés aux espèces représentées sont tous égaux à 1 :
- étape 1 : placer le contenu d’un sachet dans une fiole jaugée de volume V1 = 250 mL, ajouter 10 mL d’une solution d’hydroxyde de sodium concentrée, homogénéiser le mélange et attendre 20 minutes, puis compléter jusqu’au trait de jauge avec de l’eau distillée ;
- étape 2 : prélever un volume V2 = 5 mL de cette solution, l’introduire dans une fiole jaugée de volume V3 = 50 mL et compléter jusqu’au trait de jauge avec une solution acidifiée de nitrate de fer
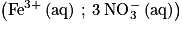 . On note S la solution obtenue, dans laquelle a été formée une espèce colorée, notée B.
. On note S la solution obtenue, dans laquelle a été formée une espèce colorée, notée B.
Les nombres stœchiométriques associés aux espèces représentées sont tous égaux à 1 :
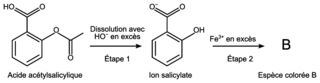 Figure 1. Étapes simplifiées de la synthèse de l’espèce colorée B |
On souhaite réaliser le dosage spectrophotométrique par étalonnage de l’espèce colorée B obtenue à l’issue de l’étape 2. On admet que seule l’espèce B absorbe dans le domaine du visible.
Pour cela, on utilise une solution mère de l’espèce colorée B, à partir de laquelle on prépare par dilution 6 solutions étalons de concentrations connues. L’une de ces solutions étalons permet de réaliser le spectre d’absorption donné sur la figure 2. On mesure l’absorbance, à la longueur d’onde λ appropriée, de chaque solution étalon. Les résultats sont donnés sur la figure 3.
Pour cela, on utilise une solution mère de l’espèce colorée B, à partir de laquelle on prépare par dilution 6 solutions étalons de concentrations connues. L’une de ces solutions étalons permet de réaliser le spectre d’absorption donné sur la figure 2. On mesure l’absorbance, à la longueur d’onde λ appropriée, de chaque solution étalon. Les résultats sont donnés sur la figure 3.
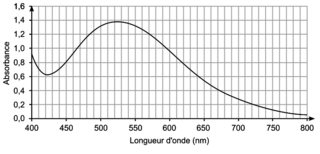 Figure 2. Spectre d’absorption d’une solution aqueuse de l’espèce colorée B à la concentration 1,74 mmol·L−1 |
Q5. Proposer une valeur de la longueur d’onde appropriée pour le dosage par étalonnage et en déduire la couleur de la solution contenant l’espèce B.
L’espèce B est une espèce colorée qui a un maximum d’absorption dans le visible. Sa couleur est la couleur complémentaire de celle absorbée.
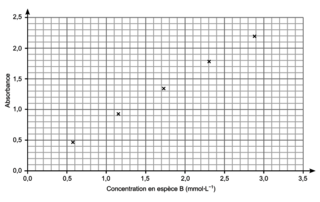 Figure 3. Absorbance en fonction de la concentration en espèce B |
La mesure de l’absorbance de la solution S obtenue à partir du sachet de médicament donne A = 0,80.
Q6. En considérant que l’incertitude-type associée à la détermination de la masse a pour valeur u(m) = 30 mg, vérifier si la masse équivalente mexp d’acide acétylsalicylique présente dans le sachet est en accord avec les informations présentes sur la notice.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et doit être correctement présentée.
La mesure de l’absorbance de la solution S donnée permet de déterminer la concentration de l’espèce B. On pourra ensuite calculer la quantité de matière de l’espèce B et enfin la masse d’acide acétylsalicylique. Il faut être néanmoins vigilant sur la détermination de la concentration de l’espèce B, puis sur la dilution de la solution.
Corrigé
Q1. L’ion acétylsalicylate :
 |
Q2. La DL-lysine possède deux groupes caractéristiques amines et un groupe carboxyle.
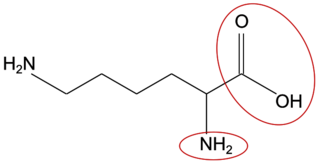 |
C’est donc un acide aminé.
Q3. Le diagramme de prédominance de l’acide acétylsalicylique :
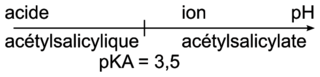 |
Le diagramme de prédominance (sans souci d’échelle) de la DL-lysine :
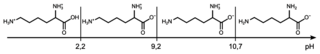 |
Le pH de la solution obtenue est 5. On est dans le domaine de prédominance de l’ion acétylsalicylate :
 |
Q4. Le titrage acide-base de cette solution aqueuse ne permet pas de déterminer la quantité d’ion acétylsalicylate, car une partie de l’acide fort utilisé lors du dosage va être utilisée pour doser la DL-lysine qui est aussi une base.
Q5. D’après le spectre d’absorption d’une solution aqueuse de l’espèce colorée B, on voit que le maximum d’absorption correspond à 530 nm. Comme la couleur de la solution est la couleur complémentaire de la couleur absorbée et que son maximum d’absorption est dans le vert, la solution est rouge d’après le cercle chromatique.
Q6. Avec la courbe d’étalonnage pour une absorption A = 0,80, on obtient une concentration c = 1,05 mmol/L.
On a donc : nB=c × V3=1,05 × 10−3 × 50 × 10−3 = 5,25 × 10−5 mol qui est la quantité de matière de l’espèce B et qui correspond également à la quantité de matière de l’ion salicylate utilisé à l’étape 2, en tenant compte de la stœchiométrie de la réaction.
Or on prélève un volume V2 = 5 mL à l’étape 2, dans le mélange qui contient 250 mL à l’étape 1.
La quantité d’ion salicylate de l’étape 1 est donc 50 fois plus grande. Soit n = 5,25 × 10−5 × 50 = 2,63 × 10−3 mol.
Comme m = n × M, on peut calculer la masse d’acide acétylsalicylique du médicament :
m =2,63 × 10−3 × 180,2 = 4,73 × 10−1 g
Pour savoir si la mesure expérimentale est en accord :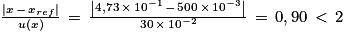 .
.
On voit que les deux résultats sont en accord.
On a donc : nB=c × V3=1,05 × 10−3 × 50 × 10−3 = 5,25 × 10−5 mol qui est la quantité de matière de l’espèce B et qui correspond également à la quantité de matière de l’ion salicylate utilisé à l’étape 2, en tenant compte de la stœchiométrie de la réaction.
Or on prélève un volume V2 = 5 mL à l’étape 2, dans le mélange qui contient 250 mL à l’étape 1.
La quantité d’ion salicylate de l’étape 1 est donc 50 fois plus grande. Soit n = 5,25 × 10−5 × 50 = 2,63 × 10−3 mol.
Comme m = n × M, on peut calculer la masse d’acide acétylsalicylique du médicament :
m =2,63 × 10−3 × 180,2 = 4,73 × 10−1 g
Pour savoir si la mesure expérimentale est en accord :
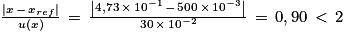 .
.On voit que les deux résultats sont en accord.