Énoncé
Exercice sur 5 points
Mots-clés : chromatographie, titrage acide-base
La vanilline (figure 1) et l'éthylvanilline (figure 2) sont responsables des arômes « vanille » utilisés dans les produits alimentaires. La vanilline peut être extraite des gousses de vanille, mais elle est très majoritairement synthétisée pour diminuer son coût. L'éthylvanilline est, quant à elle, exclusivement issue de la synthèse.
La vanilline (figure 1) et l'éthylvanilline (figure 2) sont responsables des arômes « vanille » utilisés dans les produits alimentaires. La vanilline peut être extraite des gousses de vanille, mais elle est très majoritairement synthétisée pour diminuer son coût. L'éthylvanilline est, quant à elle, exclusivement issue de la synthèse.
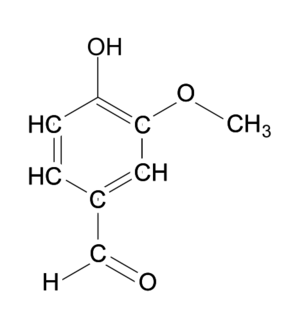 |
 |
Données :
• pKA du couple vanilline/ion vanillinate noté AH/A− à 25 °C : pKA = 7,4 ;
• masse molaire moléculaire de la vanilline : M = 152 g·mol−1 ;
• propriétés des espèces chimiques :
| | Solution aqueuse de chlorure de sodium | Acétate d'éthyle |
|---|---|---|
| Densité | Supérieure à 1 | 0,897 |
| Miscible avec l'eau | Oui | Non |
| Solubilité de la vanilline | Très peu soluble | Très soluble |
Partie 1. Étude de produits commerciaux « vanillés »
On souhaite étudier trois produits du commerce « vanillés » :
- produit 1 : produit commercial, liquide, obtenu par macération de gousses de vanille dans un mélange eau/éthanol ;
- produit 2 : sucre vanillé ;
- produit 3 : sucre vanilliné.
1. Indiquer si les molécules de vanilline et d'éthylvanilline sont des isomères de constitution. Justifier.
Déterminez la formule brute de chaque molécule.
2. Représenter la formule topologique de la molécule de vanilline.
Dans une formule topologique, toutes les liaisons sont notées sauf celles concernant les carbones et l'hydrogène.
3. Sur la molécule représentée à la question 2, entourer deux groupes caractéristiques présents et nommer, pour chacun d'eux, la famille fonctionnelle associée.
On cherche les deux groupes caractéristiques de la molécule et la famille fonctionnelle auxquels ils appartiennent. Ce sont ces groupes qui donnent les propriétés à la molécule.
On extrait la vanilline potentiellement présente du produit 2 puis du produit 3 selon le protocole ci-dessous :
- introduire, dans un erlenmeyer, 30 mL d'eau distillée et 1,0 g de produit « vanillé » ;
- introduire la solution aqueuse dans une ampoule à décanter et y ajouter 10 mL d'acétate d'éthyle ainsi qu'une spatule de chlorure de sodium ;
- agiter l'ensemble et dégazer régulièrement ;
- laisser décanter le mélange puis récupérer la phase organique.
4. Schématiser l'ampoule à décanter après agitation dans le cas du produit 2 en précisant la position relative des phases et en indiquant celle qui contient la vanilline. Justifier.
L'ampoule à décanter présente deux phases : une phase organique et une phase aqueuse. Étudiez la solubilité de substance présente dans l'ampoule à décanter ainsi que leur densité respective.
Pour vérifier la présence ou non de vanilline dans les trois produits du commerce, on réalise une chromatographie sur couche mince.
Après révélation sous lampe UV, on obtient le chromatogramme donné sur la figure 3.
Après révélation sous lampe UV, on obtient le chromatogramme donné sur la figure 3.
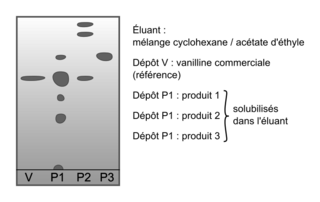 |
5. Identifier, en justifiant, les produits du commerce contenant de la vanilline.
Analysez chaque dépôt fait sur le chromatogramme et étudiez la hauteur des taches respectives.
Partie 2. Titrage de la vanilline contenu dans le produit 1
On s'intéresse dans cette partie au produit commercial obtenu par macération de gousses de vanille. La législation impose, pour obtenir l'appellation « extrait de vanille », une masse minimale de 2 g de vanilline par kilogramme d'extrait. Dans certains produits commercialisés, cette masse peut atteindre plusieurs dizaines de grammes.
Pour vérifier si le produit 1 répond à cette condition, on se propose de déterminer la masse de vanilline contenue dans un échantillon du produit commercial par un titrage suivi par pH-métrie.
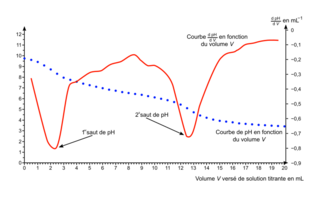
On introduit 0,31 g de produit 1 dans une fiole jaugée de 100,0 mL que l'on complète jusqu'au trait de jauge avec une solution aqueuse d'hydroxyde de sodium. On note S la solution obtenue. On réalise le titrage d'une prise d'essai de 50,0 mL de solution S par une solution aqueuse d'acide chlorhydrique de concentration égale à 4,1 × 10−3 mol·L−1. La courbe du titrage est donnée en figure 4.
Pour vérifier si le produit 1 répond à cette condition, on se propose de déterminer la masse de vanilline contenue dans un échantillon du produit commercial par un titrage suivi par pH-métrie.
On introduit 0,31 g de produit 1 dans une fiole jaugée de 100,0 mL que l'on complète jusqu'au trait de jauge avec une solution aqueuse d'hydroxyde de sodium. On note S la solution obtenue. On réalise le titrage d'une prise d'essai de 50,0 mL de solution S par une solution aqueuse d'acide chlorhydrique de concentration égale à 4,1 × 10−3 mol·L−1. La courbe du titrage est donnée en figure 4.
 |
6. Justifier que la vanilline se trouve sous forme d'ion vanillinate, noté A−, au début du titrage.
Déterminez l'espèce prédominante au pH de la solution, au début du titrage.
La courbe de la figure 4 est composée de deux sauts de pH :
- un premier saut qui correspond au titrage des ions hydroxyde présents en excès ;
- un deuxième saut qui correspond au titrage de l'ion vanillinate.
7. Écrire l'équation de la réaction support du titrage entre l'ion vanillinate et l'acide chlorhydrique.
La réaction support du titrage est une réaction totale entre une base : l'ion vanillinate et un acide fort. Les ions chlorure sont des ions spectateurs.
8. Vérifier si l'appellation « extrait de vanille » peut être attribuée à l'extrait étudié.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n'a pas abouti. La démarche suivie est évaluée et nécessite donc d'être correctement présentée.
Il faut vérifier la mention « extrait de vanille » c'est-à-dire s'il y a bien 2 g de vanille par kilogramme d'extrait. Exploitez le volume à l'équivalence pour déterminer la quantité d'acide puis la masse réellement présente dans la solution.
Corrigé
Partie 1. Étude de produits commerciaux « vanillés »
1. Les formules brutes des deux molécules sont : pour la vanilline, C8H8O3 et pour l'éthylvanilline C9H10O3. Les deux molécules n'ont pas la même formule brute, elles ne sont pas isomères de constitution.
2. La formule topologique :
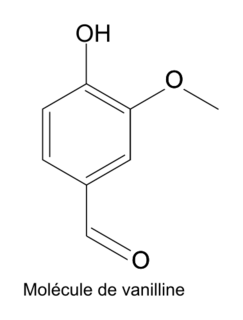 |
3. Les groupes caractéristiques de la molécule :
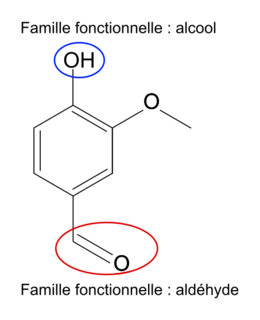 |
4. L'ampoule à décanter :
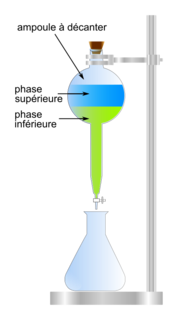 |
Dans la phase supérieure, il y aura l'acétate d'éthyle, dont la densité est inférieure à 1 et la vanilline qui est très soluble.
Dans la phase inférieure, il y aura la solution aqueuse de chlorure de sodium dont la densité est supérieure à 1.
Dans la phase inférieure, il y aura la solution aqueuse de chlorure de sodium dont la densité est supérieure à 1.
5. Lors d'une CCM, une même espèce chimique migre toujours à la même hauteur. D'après le chromatogramme, on trouve des taches correspondant à la vanilline (taches à la même hauteur) sur le produit 1 et le produit 2. En revanche, le produit 3 ne contient pas de vanilline : pas de tache à cette hauteur.
Partie 2. Titrage de la vanilline contenu dans le produit 1
6. Le pH au début du titrage est de 9,8 environ. Le domaine de prédominance du couple mis en jeu ici est :
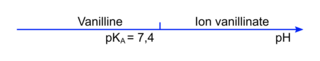 |
À ce pH, on se trouve dans le domaine de prédominance de l'ion vanillinate A−.
7. L'équation support de la réaction de titrage est :
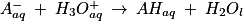
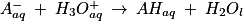
8. Pour obtenir la mention « extrait de vanille », il faut une masse de 2 g de vanilline par kilogramme d'extrait.
Grâce au titrage, on peut déterminer la quantité de matière nS d'ion vanillinate présente dans VS = 50,0 mL de solution S.
Le volume d'acide chlorhydrique est donc, d'après l'énoncé : VE = 12,6-2,2 = 10,4 mL.
À l'équivalence, on peut écrire que n(A−) = n (H3O+)
D'où n(A−) = C(H3O+) × VE
Soit n(A−) = 4,1 × 10−3 × 10,4 × 10−3 = 4,3 × 10−5 mol
On aura alors une quantité de vanilline égale aussi à 4,3 × 10−5 mol (simple réaction avec l'hydroxyde de sodium au départ).
m = n × M = 4,3 × 10−5 × 152 = 6,5 × 10−3 g dans les 50,0 mL de la solution S qui représente la moitié de la solution S de départ.
Dans la solution S, il y aura m = 6,5 × 10−3 × 2 = 1,3 × 10−2 g
On a donc cette masse de vanilline dans le 0,31 g de produit au départ. Pour pouvoir conclure, il faut calculer pour 1 kg :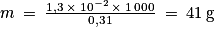
Le produit peut donc bien être considéré comme un « extrait de vanille ».
Grâce au titrage, on peut déterminer la quantité de matière nS d'ion vanillinate présente dans VS = 50,0 mL de solution S.
Le volume d'acide chlorhydrique est donc, d'après l'énoncé : VE = 12,6-2,2 = 10,4 mL.
À l'équivalence, on peut écrire que n(A−) = n (H3O+)
D'où n(A−) = C(H3O+) × VE
Soit n(A−) = 4,1 × 10−3 × 10,4 × 10−3 = 4,3 × 10−5 mol
On aura alors une quantité de vanilline égale aussi à 4,3 × 10−5 mol (simple réaction avec l'hydroxyde de sodium au départ).
m = n × M = 4,3 × 10−5 × 152 = 6,5 × 10−3 g dans les 50,0 mL de la solution S qui représente la moitié de la solution S de départ.
Dans la solution S, il y aura m = 6,5 × 10−3 × 2 = 1,3 × 10−2 g
On a donc cette masse de vanilline dans le 0,31 g de produit au départ. Pour pouvoir conclure, il faut calculer pour 1 kg :
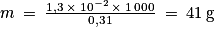
Le produit peut donc bien être considéré comme un « extrait de vanille ».

