Énoncés
Exercice 1 (Afrique, 2013)
L'estérification est une transformation chimique au cours de laquelle un ester, de formule générale R1 − COO − R2, est obtenu par réaction entre un acide carboxylique R1 − COOH et un alcool R2 − OH. Il se forme aussi de l'eau selon l'équation :
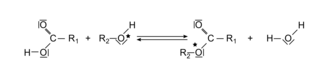 |
L'oxygène marqué O* de l'alcool est celui qu'on retrouve généralement dans l'ester.
1. Nommer et donner les formules semi-développées des deux réactifs de la réaction ci-dessus, conduisant à la formation de l'éthanoate de butyle.
2. Indiquer si la réaction d'estérification est une réaction de substitution, d'addition ou d'élimination. Justifier.
3. Repérer les sites donneurs et accepteurs de doublets électroniques dans les réactifs.
La bonne méthode
1. Appliquer la méthode de nomenclature vue en cours.
2. Repérer s'il y a ajout, retrait ou substitution d'un groupe caractéristique dans l'acide carboxylique pour obtenir l'ester.
3. Un atome électronégatif a tendance à être en excès de charge électronique et donc à être donneur, alors qu'un atome en contact avec un ou plusieurs atomes électronégatifs a tendance à être receveur de doublets électroniques.
Exercice 2
L'acide benzoïque est un conservateur alimentaire souvent présent dans les sodas. Une méthode de synthèse de l'acide benzoïque peut s'effectuer en deux étapes au laboratoire.
Étape (a) : obtention de l'ion benzoate à partir du benzonitrile
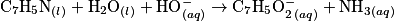
Étape (b) : obtention de l'acide benzoïque par réaction de l'ion benzoate avec l'ion oxonium
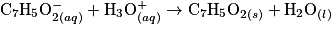
Le but de cette partie est d'analyser un protocole mis en œuvre pour effectuer cette synthèse au laboratoire ; la description des opérations successives figure ci-après.
Étape (a) : obtention de l'ion benzoate à partir du benzonitrile
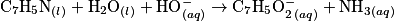
Étape (b) : obtention de l'acide benzoïque par réaction de l'ion benzoate avec l'ion oxonium
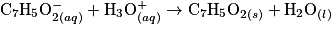
Le but de cette partie est d'analyser un protocole mis en œuvre pour effectuer cette synthèse au laboratoire ; la description des opérations successives figure ci-après.
(1) Dans un ballon de 100 mL, introduire un volume de 2,0 mL de benzonitrile, un volume de 24 mL d'une solution aqueuse d'hydroxyde de sodium à 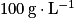 , et quelques grains de pierre ponce.
, et quelques grains de pierre ponce.
(2) Adapter un réfrigérant à eau, puis porter à ébullition pendant plusieurs dizaines de minutes.
(3) Une fois la réaction terminée, verser le contenu du ballon dans un bécher, puis le refroidir à l'aide d'un bain de glace.
(4) Ajouter de l'acide chlorhydrique froid en excès.
(5) Filtrer sur Büchner (penser à laver les cristaux avec une solution froide acidifiée).
(6) Placer les cristaux à l'étuve (enceinte chauffante thermostatée) pendant une heure.
(7) Peser le produit obtenu.
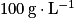 , et quelques grains de pierre ponce.
, et quelques grains de pierre ponce.(2) Adapter un réfrigérant à eau, puis porter à ébullition pendant plusieurs dizaines de minutes.
(3) Une fois la réaction terminée, verser le contenu du ballon dans un bécher, puis le refroidir à l'aide d'un bain de glace.
(4) Ajouter de l'acide chlorhydrique froid en excès.
(5) Filtrer sur Büchner (penser à laver les cristaux avec une solution froide acidifiée).
(6) Placer les cristaux à l'étuve (enceinte chauffante thermostatée) pendant une heure.
(7) Peser le produit obtenu.
1. Dans l'opération (1), peut-on remplacer la solution aqueuse d'hydroxyde de sodium par des pastilles d'hydroxyde de sodium solide pour réaliser la synthèse ? Justifier.
2. Quelles opérations correspondent à l'étape (a) de la synthèse de l'acide benzoïque ?
3. Donner deux raisons qui justifient l'utilisation du chauffage à reflux.
4. Donner les rôles de chacune des opérations (4), (5) et (6).
La bonne méthode
1. Analyser l'équation de la réaction de l'étape (a).
2. Attribuer les différentes opérations expérimentales à la réaction de l'étape (a).
3. Le chauffage à reflux comporte deux parties avec deux avantages : la partie chauffage et la partie reflux.
4. L'opération (4) est à mettre en rapport à l'étape (b). Les opérations (5) et (6) sont des techniques de séparation et de purification d'un solide.
Corrigés
Exercice 1
1.
La formule semi-développée de l'éthanoate de butyle est la suivante :
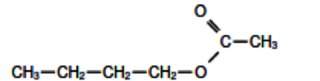 |
On reconnaît le groupe R1 = −CH3 et R2 = −CH2 −CH2 − CH2 − CH3 dans la molécule représentée, ce qui nous permet d'en déduire les réactifs. Il s'agit de l'acide éthanoïque :
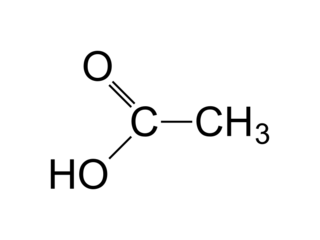 |
et du butan-1-ol : CH3 − CH2 − CH2 − CH2 − OH.
2. On remarque que le groupe R2 − OH a remplacé le groupe carboxyle de l'acide carboxylique. On en déduit qu'il s'agit d'une réaction de substitution.
3. Les atomes électronégatifs ont tendance à être en excès de charge électronégatives (que l'on note δ−) et donc à être donneur de doublets électroniques. C'est le cas ici des atomes d'oxygène. Par suite, les atomes en contact direct avec un ou plusieurs atomes électronégatifs ont tendance à être receveur de doublets électroniques. On les note δ+. C'est le cas ici du carbone du groupe carboxyle de l'acide éthanoïque et de l'hydrogène du groupe alcool du butan-1-ol.
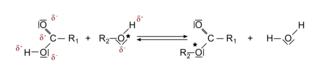 |
Remarque : on peut, à partir de ce raisonnement, imaginer le mécanisme réactionnel de formation d'éthanoate de butyle (plusieurs scénarios sont possibles).
Exercice 2
1. L'un des réactifs de l'étape (a) est l'eau. Or l'eau est apportée par la solution aqueuse d'hydroxyde de sodium. Avec l'utilisation de pastilles, il n'y aurait plus l'eau nécessaire à la réaction. On ne peut donc pas utiliser de pastilles d'hydroxyde de sodium.
2. Les opérations (1), (2) et (3) correspondent à l'étape (a) de l'obtention de l'ion benzoate.
3. Le chauffage permet d'accélérer la réaction, et l'emploi du réfrigérant permet d'éviter de perdre de la matière.
4. L'opération (4) est une réaction acido-basique correspondant à l'étape (b). Le fait de baisser la température entraîne la précipitation de l'acide benzoïque qui est moins soluble à froid.
L'opération (5) est une filtration pour récupérer l'acide benzoïque qui vient de précipiter.
L'opération (6) est un séchage afin de débarrasser les cristaux d'acide benzoïque de toute trace d'eau.
L'opération (5) est une filtration pour récupérer l'acide benzoïque qui vient de précipiter.
L'opération (6) est un séchage afin de débarrasser les cristaux d'acide benzoïque de toute trace d'eau.

