Modéliser l'évolution temporelle d'un système, siège d'une transformation nucléaire
Énoncés
Exercice 1 (Asie, 2003)
1. Par quels nombres caractérise-t-on le noyau d'un atome ?
2. Le « carbone 11 » et le « carbone 12 » sont deux isotopes. Qu'est-ce qui différencie les isotopes d'un même élément chimique ?
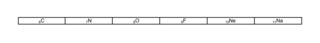
3. L'« oxygène 15 » est radioactif β+. Écrire l'équation de la désintégration correspondante. On supposera que le noyau fils n'est pas émis dans un état excité.
 |
La bonne méthode
1. Question de cours sur la composition d'un noyau atomique.
2. Question de cours également.
3. Utiliser l'équation de réaction de la désintégration β+ avec comme réactif _{8}^{15}\textrm{O}.
Exercice 2 (Nouvelle-Calédonie, 2004)
La glande thyroïde produit des hormones essentielles à différentes fonctions de l'organisme, à partir de l'iode alimentaire. Pour vérifier la forme ou le fonctionnement de cette glande, on procède à une scintigraphie thyroïdienne en utilisant les isotopes 131(_{53}^{131}\textrm{I}) ou 123(_{53}^{123}\textrm{I}) de l'iode. Pour cette scintigraphie, un patient ingère une masse m = 1,00 μg de l'isotope _{53}^{131}\textrm{I}, soit 4,60 × 1015 atomes. La demi-vie de l'isotope _{53}^{131}\textrm{I} vaut 8,0 jours.
1. Rappeler la loi de décroissance radioactive en faisant intervenir N0 et la constante radioactive λ.
2. Définir le temps de demi-vie t1/2 d'un échantillon radioactif. En déduire la relation \lambda \times t_{1/2}=\ln 2.
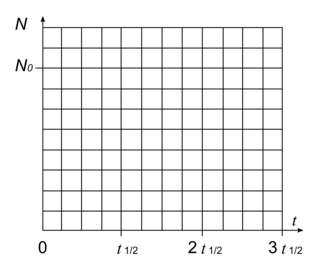
3. Tracer, sur la figure ci-dessous, l'allure de la courbe correspondant à l'évolution au cours du temps du nombre de noyaux radioactifs dans l'échantillon, en justifiant le raisonnement utilisé. On placera correctement les points correspondant aux instants t1/2, 2t1/2 et 3t1/2.
 |
La bonne méthode
1. Question de cours.
2. Se souvenir de la définition du temps de demi-vie d'un atome radioactif, puis exploiter la loi de décroissance radioactive.
3. Utiliser la définition de t1/2 pour exprimer les valeurs de N aux temps t1/2, 2t1/2 et 3t1/2. Il faut également se souvenir que quel que soit l'instant à partir duquel on observe une désintégration radioactive, elle suivra la même loi.
Corrigés
Exercice 1
1.
On caractérise le noyau d'un atome par deux nombres :
• le nombre de masse A, qui représente le nombre de nucléons, c'est-à-dire le nombre total de protons et de neutrons ;
• le nombre de charge ou numéro atomique Z, qui représente le nombre de protons.
2. Ce qui différencie deux isotopes d'un élément chimique est leur nombre de masse A. Ainsi, deux isotopes ont le même numéro atomique, c'est-à-dire le même nombre de protons, mais des nombres de neutrons différents.
3. La désintégration radioactive de l'oxygène 15 est de type β+. Ainsi, l'équation de réaction s'écrit : _{8}^{15}\textrm{O}\rightarrow _{7}^{15}\textrm{N}+_{+1}^{0}\textrm{e}
Exercice 2 (Nouvelle-Calédonie, 2004)
1. La loi de désintégration radioactive s'écrit N(t)=N_{0}\textrm{e}^{-\lambda t}, avec λ la constante radioactive et N0 la population initiale en noyaux radioactifs.
2. Le temps de demi-vie t1/2 correspond au temps au bout duquel la moitié des noyaux radioactifs ont disparu. On a donc N(t_{1/2})=\frac{N_{0}}{2}.
Or N(t_{1/2})=N_{0}\textrm{e}^{-\lambda t_{1/2}}, donc N_{0}\textrm{e}^{-\lambda t_{1/2}}=\frac{N_{0}}{2}\Leftrightarrow \textrm{e}^{-\lambda t_{1/2}}=\frac{1}{2}\Leftrightarrow -\lambda t_{1/2}=\ln \left ( \frac{1}{2} \right )=-\ln 2
Donc λt1/2 = ln2.
Or N(t_{1/2})=N_{0}\textrm{e}^{-\lambda t_{1/2}}, donc N_{0}\textrm{e}^{-\lambda t_{1/2}}=\frac{N_{0}}{2}\Leftrightarrow \textrm{e}^{-\lambda t_{1/2}}=\frac{1}{2}\Leftrightarrow -\lambda t_{1/2}=\ln \left ( \frac{1}{2} \right )=-\ln 2
Donc λt1/2 = ln2.
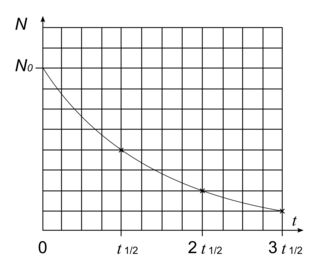
3.
On sait que :
• pour t = 0, on a N0 noyaux radioactifs ;
• pour t = t1/2, on a par définition N(t_{1/2})=\frac{N_{0}}{2}.
De plus, quel que soit l'instant à partir duquel on observe une désintégration radioactive, elle suit toujours la même loi. L'instant t = 2t1/2 est équivalent au temps de demi-vie de la désintégration radioactive prise à partir de l'instant t = t1/2. On peut faire le même raisonnement ensuite pour t = 3t1/2. On a donc :
• pour t = 2t1/2, on a N(2t_{1/2})=\frac{N(t_{1/2})}{2}=\frac{\frac{N_{0}}{2}}{2}=\frac{N_{0}}{4} ;
• pour t = 3t1/2, on a N(3t_{1/2})=\frac{N(2t_{1/2})}{2}=\frac{\frac{N_{0}}{4}}{2}=\frac{N_{0}}{8}.
Tout cela nous permet de tracer la courbe de désintégration de l'isotope d'iode.
 |

