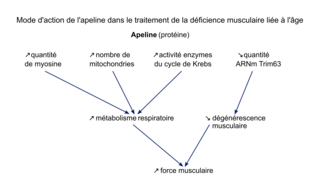
Lors d'un effort physique, les muscles sont capables d'exercer une force musculaire permettant la réalisation des mouvements. Or, cette force musculaire diminue avec l'âge. Récemment, une hormone protéique, l'apeline, a été identifiée et pourrait constituer un traitement intéressant pour limiter la diminution de la force musculaire avec l'âge. Quel est le mode d'action de l'apeline dans le traitement de la perte de la force musculaire liée à l'âge ? Pour répondre à cette question, nous caractériserons l'évolution de la quantité d'apeline dans les muscles au cours du temps. Puis nous analyserons les différentes caractéristiques des fibres musculaires présentées par des souris ne produisant pas d'apeline. Enfin, nous étudierons les conséquences sur les muscles de l'injection d'apeline chez des souris.
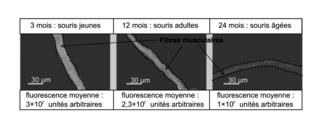
L'apeline est une hormone protéique constituée d'une vingtaine d'acides aminés. Le document 2 présente le résultat de la localisation et de l'estimation de la quantité d'apeline par immunofluorescence au niveau des muscles de souris d'âge croissant. Les études en immunofluorescence montrent que l'apeline est localisée au niveau des fibres musculaires chez les souris concernées, quel que soit leur âge. Cependant, les souris âgées de 24 mois présentent au niveau de leurs fibres musculaires une moindre fluorescence liée à l'apeline que les souris plus jeunes. La quantification de la fluorescence associée à cette protéine montre que l'intensité de la fluorescence décroît au cours de la vie de la souris : elle est divisée par 3 chez les souris âgées de 24 mois (1 × 10
7 unités arbitraires) par rapport aux souris âgées de 3 mois (3 × 10
7 unités arbitraires). Ainsi, chez les souris, la quantité d'apeline présente dans les fibres musculaires diminue avec l'âge de l'individu.
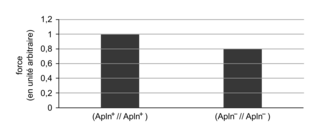
Le document 3a compare la force musculaire exercée par des souris homozygotes (Apln
+//Apln
+) produisant de l'apeline à celle développée par des souris homozygotes (Apln
−//Apln
−) ne produisant pas d'apeline. Le gène
APLN est le gène codant la protéine apeline. Les souris (Apln
+//Apln
+) âgées de 12 mois et produisant de l'apeline présentent une force musculaire de 1
UA (unité arbitraire), alors que les souris (Apln
−//Apln
−) de même âge et déficientes en apeline ne produisent qu'une force musculaire de 0,8
UA. Ainsi, la déficience en apeline est associée à une force musculaire plus faible. La mise en relation du résultat de cette étude avec ceux du document 2 suggère que la diminution de quantité d'apeline musculaire avec l'âge pourrait contribuer à la baisse de la force musculaire liée à l'âge.
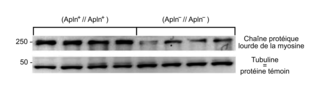
Le document 3b présente une comparaison des résultats de l'électrophorèse de protéines musculaires de souris (Apln
+//Apln
+) avec ceux obtenus chez des souris (Apln
−//Apln
−). La tubuline, protéine du cytosquelette des cellules musculaires, sert de témoin et est présente en quantité comparable chez les deux types de souris. À l'opposé, l'étude de la chaîne protéique lourde de myosine montre que celle-ci est en quantité significativement plus importante chez les souris (Apln
+//Apln
+) que chez les souris (Apln
−//Apln
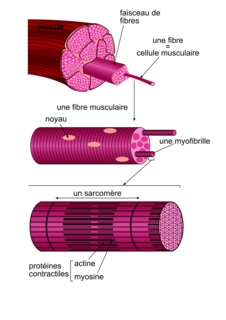
−). Or, d'après le document 1 qui présente l'organisation d'un muscle strié squelettique, les fibres musculaires sont constituées de myofibrilles, riches en myosine et en actine qui sont des protéines contractiles. Ainsi, la déficience en apeline, observée chez les souris (Apln
−//Apln
−), est associée à une moindre quantité de myosine. Cette moindre quantité de myosine pourrait expliquer la moindre force musculaire observée chez les souris déficientes en apeline.
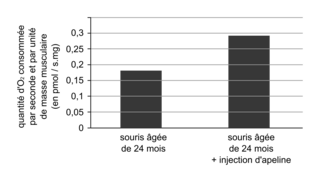
Le document 6 compare la consommation en O
2 des fibres musculaires de souris âgées de 24 mois, traitées ou non à l'apeline. Les fibres musculaires des souris traitées à l'apeline présentent une consommation en O
2 0,29 pmol

s
−1
mg
−1, qui est significativement supérieure à celle des souris de même âge non traitées (0,18 pmol

s
−1
mg
−1). Or la consommation en O
2 reflète l'intensité de la respiration cellulaire, métabolisme permettant la production d'énergie pour la contraction musculaire. En effet, la respiration se caractérise par un ensemble de réactions au sein des mitochondries, permettant la production d'
ATP (Adénosine triphosphate) utilisé pour la contraction de la fibre musculaire. Ainsi, l'injection d'apeline permet une augmentation de l'intensité de la respiration, contribuant à un fonctionnement accru du muscle. Mais quels mécanismes permettent l'augmentation de la respiration sous l'effet de l'apeline ?
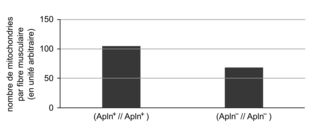
Le document 4 présente les résultats de l'évaluation du nombre de mitochondries dans les fibres musculaires. Le nombre de mitochondries par fibre musculaire chez un individu (Apln
+//Apln
+) est de 100 UA, ce qui est significativement supérieur à celui d'un individu (Apln
−//Apln
−), qui n'en possède que 60 UA. La déficience en apeline est donc associée à une diminution du nombre de mitochondries dans les fibres musculaires. De plus, le document 5b précise que l'injection d'apeline chez des souris (Apln
−//Apln
−) entraîne l'activation de certaines enzymes du cycle de Krebs. Or le cycle de Krebs est l'ensemble des réactions, ayant lieu dans la matrice mitochondriale, qui permettent la décarboxylation du pyruvate et sont suivies par les réactions au niveau de la chaîne respiratoire aboutissant à la production d'ATP, forme d'énergie utilisée pour réaliser les contractions musculaires. Ainsi, la présence d'apeline est corrélée à un nombre accru de mitochondries dans les fibres musculaires et à une activation plus importante des enzymes impliquées dans la respiration cellulaire, ce qui peut expliquer l'augmentation de l'intensité de la respiration mise en évidence dans le document 6.
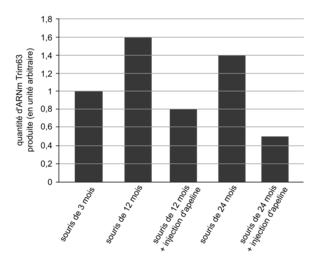
Enfin, le document 5b présente une étude portant sur la protéine Trim63 impliquée dans la dégénérescence musculaire. L'étude montre que la quantité de l'ARNm Trim63 est plus élevée chez les souris âgées de 12 mois (1,6 UA) et de 24 mois (1,4 UA) que chez les souris de 3 mois (1 UA). L'augmentation de la quantité d'ARNm Trim63 avec l'âge serait à l'origine de l'augmentation de la quantité de la protéine Trim63 avec l'âge, qui accentuerait la dégénérescence musculaire. Or l'injection d'apeline diminue significativement la quantité de l'ARNm Trim63 chez des souris âgées de 12 mois (0,8 UA avec apeline contre 1,6 UA sans apeline) et de 24 mois (0,5 UA avec apeline contre 1,4 UA sans apeline). Ainsi, l'apeline exercerait une inhibition de la production de l'ARNm Trim63 codant une protéine impliquée dans la dégénérescence musculaire, expliquant l'effet de l'apeline dans la diminution de la déficience musculaire liée à l'âge.
Ainsi, le vieillissement de l'organisme entraîne une diminution de la force de contraction musculaire. Des recherches sont en cours pour limiter cette déficience musculaire qui peut être dommageable pour les personnes âgées. L'identification d'une protéine, l'apeline, ouvre des perspectives intéressantes dans le traitement de la déficience musculaire liée à l'âge. Chez les souris, les études menées montrent qu'une faible quantité d'apeline est associée à une déficience musculaire, et que l'injection d'apeline permet de restaurer les capacités musculaires. Le traitement à l'apeline entraîne une augmentation de la force musculaire par différents mécanismes : augmentation de la quantité des protéines contractiles musculaires, inhibition de la dégénérescence musculaire et augmentation de l'activité respiratoire. Dans quelle mesure les résultats expérimentaux prometteurs obtenus chez les souris pourront-ils être reproduits dans le traitement de la déficience musculaire liée à l'âge dans l'espèce humaine ?
 s−1
s−1 mg−1, qui est significativement supérieure à celle des souris de même âge non traitées (0,18 pmol
mg−1, qui est significativement supérieure à celle des souris de même âge non traitées (0,18 pmol s−1
s−1 mg−1). Or la consommation en O2 reflète l'intensité de la respiration cellulaire, métabolisme permettant la production d'énergie pour la contraction musculaire. En effet, la respiration se caractérise par un ensemble de réactions au sein des mitochondries, permettant la production d'
mg−1). Or la consommation en O2 reflète l'intensité de la respiration cellulaire, métabolisme permettant la production d'énergie pour la contraction musculaire. En effet, la respiration se caractérise par un ensemble de réactions au sein des mitochondries, permettant la production d'