Mucoviscidose : mutations et traitement, sujet de métropole, mars 2023, exercice 2
Énoncé
Exercice sur 8 points
La mucoviscidose est une maladie génétique qui touche principalement les voies respiratoires et le système digestif. En 1989, le gène CFTR responsable de la maladie a été identifié sur le chromosome 7. Le développement des techniques de séquençage a permis d'identifier près de 2 000 mutations différentes de ce gène.
Depuis 2021, un traitement associant 3 molécules et considéré comme une véritable révolution thérapeutique est proposé à certains patients.
La mucoviscidose est une maladie génétique qui touche principalement les voies respiratoires et le système digestif. En 1989, le gène CFTR responsable de la maladie a été identifié sur le chromosome 7. Le développement des techniques de séquençage a permis d'identifier près de 2 000 mutations différentes de ce gène.
Depuis 2021, un traitement associant 3 molécules et considéré comme une véritable révolution thérapeutique est proposé à certains patients.
QUESTION :
Expliquer pourquoi ce nouveau traitement n'est prescrit qu'aux patients atteints de mucoviscidose présentant la mutation.
Vous organiserez votre réponse selon une démarche de votre choix intégrant des données des documents et les connaissances utiles.
Document 1 : mutations du gène CFTR et conséquences sur la protéine
Document 1a : rôle de la protéine CFTR
La protéine CFTR est un canal chlore inséré dans la membrane des cellules de différentes muqueuses : respiratoire, digestive… Elle est constituée de 1 480 acides aminés. Ce canal permet la sortie d'ions chlorure (Cl−) des cellules. Dans le cas des cellules respiratoires, cet échange d'ions est indispensable pour obtenir un mucus suffisamment fluide, permettant ainsi l'élimination de bactéries et d'impuretés qui s'y déposent.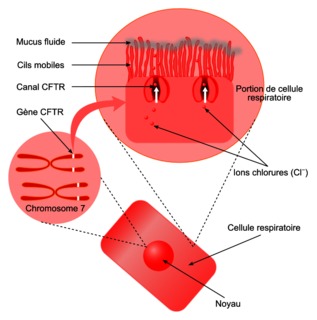 Source : ABCF Mucoviscidose |
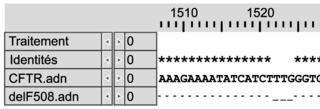
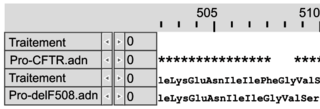
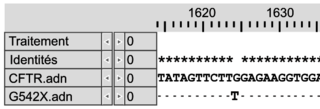
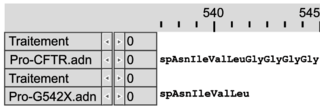
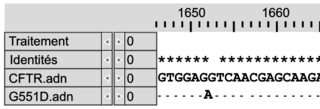
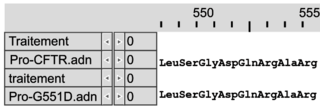
Document 1b : comparaison des séquences nucléotidiques de quatre allèles du gène CFTR et comparaison des séquences en acides aminés des protéines CFTR correspondantes
Les séquences nucléotidiques de trois allèles mutés du gène codant la protéine CFTR (delF508, G542X et G551D) sont comparées à la séquence non mutée (CFTR).Les séquences en acides aminés des protéines correspondantes (Pro-delF508, Pro-G542X, Pro-G551D) sont comparées à la séquence en acides aminés de la protéine fonctionnelle (Pro-CFTR).
| | Comparaison des séquences nucléotidiques avec la séquence CFTR non mutée | Comparaison des séquences en acides aminés avec la protéine fonctionnelle | ||
| Mutation delF508 |
|
| ||
| Mutation G542X |
|
| ||
| Mutation G551D |
|
|
Source : d'après la banque de données du logiciel Anagène
Légende :
– et * : nucléotides identiques
– : délétion de nucléotides
Légende :
– et * : nucléotides identiques
– : délétion de nucléotides
Document 2 : conséquences de mutations sur l'état de maturation de la protéine CFTR
La protéine CFTR subit différentes modifications dans le réticulum endoplasmique, un organite cellulaire. D'une forme immature d'environ 140 kilodaltons (kDa, unité de mesure de masse moléculaire), elle est transformée en une forme mature de 170 kDa. Seule cette protéine CFTR mature est capable ensuite de s'insérer dans la membrane plasmique pour y exercer sa fonction de canal chlore.Le poids moléculaire des protéines CFTR dans des cellules présentant ou non une mutation peut être déterminé par électrophorèse, une technique de laboratoire qui permet de séparer des molécules chargées au travers d'un gel sous l'effet d'un champ électrique. Après révélation avec une technique adaptée, celles-ci sont alors visualisables sous forme de bandes. Une bande sombre indique la présence d'une molécule.
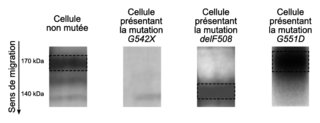 Sources : d'après « Ataluren Stimulates Ribosomal Selection of Near-Cognate tRNAs to Promote Nonsense Suppression », B. Roy et al., 2016, et « G551D Mutation Impairs PKA-Dependent Activation of CFTR Channel That Can Be Restored by Novel GOF Mutations », W. Wang et al., 2020 |
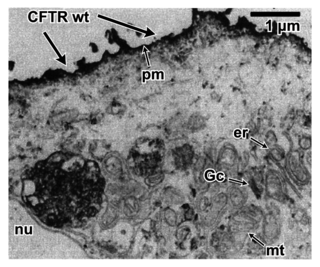
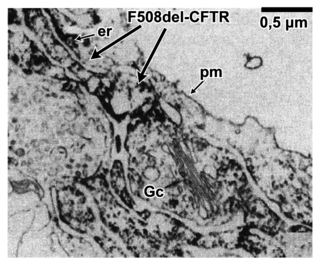
Document 3 : localisation des protéines CFTR fonctionnelles et CFTR delF508
Une étude de 1993 montre par microscopie électronique où se situent les protéines CFTR fonctionnelles (notées CFTR wt) et CFTR delF508 dans des cellules. La protéine CFTR est visualisée en noir.| Cellule d’un individu non atteint | Cellule d’un individu atteint | ||
|
|
nu : noyau, er : réticulum endoplasmique, mt : mitochondrie, Gc : appareil de Golgi, pm : membrane plasmique
Sources : d'après Yang et al., 1993, et Dormer et al., 2001Document 4 : un traitement novateur adapté à certains patients atteints de mucoviscidose
Un nouveau traitement associant trois molécules (VX-445 + VX-661 + VX-770) est disponible depuis 2021 en France pour les patients présentant la mutation delF508, âgés de plus de 12 ans.Document 4a : effet du nouveau traitement sur la protéine CFTR
Le document présente le résultat d'une électrophorèse permettant de mettre en évidence l'état de maturation de la protéine CFTR dans les cellules de deux sujets porteurs de la mutation delF508. Le principe de l'électrophorèse est le même que dans le document 2. Les pointillés indiquent les limites des bandes sombres visibles.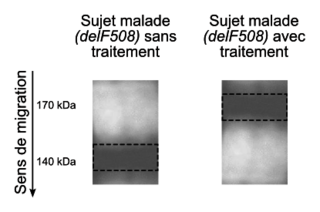 Source : d'après « Rescue of Multiple Class II CFTR Mutation by Elexacaftor+Tezacaftor+Ivacaftor », O. Laselva et al., European Respiratory Journal, 2021 |
Document 4b : évolution du VEMS lors d'une étude clinique chez des patients atteints de mucoviscidose et porteurs de la mutation delF508
Le principal critère d'évaluation de l'efficacité du traitement est le VEMS, qui correspond au volume maximum d'air qu'une personne peut expirer en une seconde, comparé aux valeurs d'une personne présentant des caractéristiques similaires (telles que le poids, la taille et le sexe).L'étude a été menée sur 403 sujets porteurs de la mutation delF508, dont 200 ont reçu le traitement et 203 le placebo (un produit sans principe actif qui n'a donc aucun effet). Ni le patient ni l'expérimentateur ne savent qui reçoit le médicament ou le placebo.
Au début de l'étude, les patients présentaient des valeurs moyennes de VEMS de seulement 60 à 68 % de celles observées chez une personne moyenne en bonne santé.
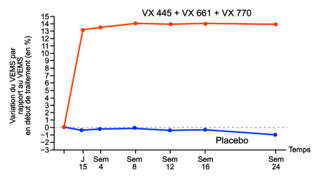 Source : « Elexacaftor-Tezacaftor-Ivacaftor for Cystic Fibrosis with a Single Phe508del Allele », P. G. Middelton et al., The New England Journal of Medicine, 2019 |
J15 = jour 15
Sem = semaine
Sem = semaine
Annexes
© 2000-2025, Miscellane