Sujet de métropole prévu en mars 2021, exercice A
Énoncé
Mots-clés : réactions acide-base ; dosage par titrage. Les anthocyanes sont des espèces chimiques responsables de la couleur de nombreux végétaux, comme le chou rouge, l'hortensia ou encore l'aubergine. L'une des propriétés remarquables des anthocyanes est que leur couleur en solution dépend fortement du pH de cette solution. Dans cet exercice, on se propose de modéliser un indicateur coloré naturel contenant des anthocyanes pour pouvoir l'utiliser lors du titrage d'un lait fermenté.
Numéros atomiques des éléments hydrogène, carbone et oxygène :
 |
Constante d'acidité à 20 °C du couple acide lactique/ion lactate : 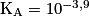
L'acidité Dornic d'un lait, exprimée en degré Dornic de symbole °D, est reliée à la concentration en masse d'acide lactique dans ce lait en considérant qu'il est le seul acide présent : 1,0 °D correspond à une concentration en masse en acide lactique égale à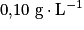 .
.
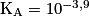
L'acidité Dornic d'un lait, exprimée en degré Dornic de symbole °D, est reliée à la concentration en masse d'acide lactique dans ce lait en considérant qu'il est le seul acide présent : 1,0 °D correspond à une concentration en masse en acide lactique égale à
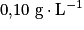 .
.1. Modélisation d'un indicateur coloré naturel issu du chou rouge
La couleur du chou rouge est principalement due à la présence d'une vingtaine d'anthocyanes différentes. Pour comprendre l'influence du pH du milieu sur la couleur, on modélise ce mélange complexe d'espèces chimiques par une seule espèce chimique, la cyanidine (figure 1), dont la structure est commune à toutes les anthocyanes.
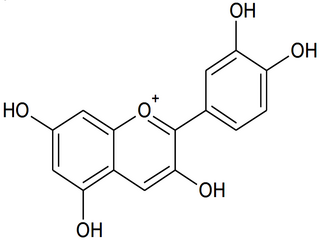 |
On limite la modélisation à des milieux où le pH est compris entre 4,5 et 9,0. Dans cet intervalle, la cyanidine existe principalement sous trois formes :
 |
Au laboratoire, on prépare une solution de jus de chou rouge en faisant macérer pendant dix minutes dans de l'eau distillée chaude le quart d'un chou rouge coupé en morceaux. On filtre le mélange et on obtient une solution aqueuse de couleur violet-bleu intense. On fait varier le pH de la solution et on note la couleur correspondante :
 |
1.1. Justifier que la forme n° 1 est une espèce amphotère.
Une espèce amphotère est une espèce qui peut se comporter comme un acide, mais également comme une base : elle appartient donc à deux couples acido-basiques.
1.2. Recopier puis compléter les pointillés du diagramme de prédominance ci-après pour cet indicateur coloré. Associer une couleur à chaque forme en solution aqueuse.
 |
Il faut chercher, parmi les formes de la cyanidine, la forme la plus acide et la forme la plus basique. Pour cela, revenez à la définition d'un acide au sens de Brönsted.
2. Titrage d'un lait fermenté
Pour préparer des fromages ou des yaourts, il est nécessaire de faire fermenter du lait frais. Des bactéries appelées ferments lactiques sont utilisées pour transformer notamment le lactose du lait frais en acide lactique (figure 2). Lors de la fabrication des produits laitiers, pour déterminer l'avancement de la fermentation du lait, les techniciens réalisent un titrage acido-basique de l'acide lactique formé afin de déterminer l'acidité Dornic. L'acidité Dornic d'un lait doit être supérieure à 80 °D pour pouvoir fabriquer un yaourt.
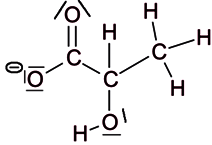 |
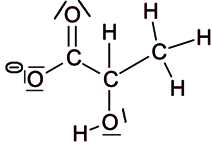
2.1. Représenter le schéma de Lewis de l'ion lactate.
La formule de Lewis d'une entité chimique correspond à la forme développée de cette entité et tient compte des doublets non liants autour de chaque atome.
2.2. Justifier que la fermentation du lait contribue à acidifier celui-ci.
Lors de la fermentation, des bactéries sont utilisées pour transformer le lactose du lait frais en une molécule. Analysez la formation cette molécule.
2.3.1. On veut modéliser la transformation chimique entre l'acide lactique et l'eau du lait. On notera AH l'acide lactique et l'ion lactate. Écrire l'équation de la réaction modélisant cette transformation chimique.
Écrivez l'équation de la réaction entre l'acide lactique et l'eau. Pour cela, déterminez auparavant les deux couples acido-basiques mis en jeu dans cette réaction.
2.3.2. Montrer que cette transformation chimique est spontanée. On admettra que la concentration initiale en ion lactate est nulle.
Calculez le quotient de la réaction précédente, à l'état initial. La valeur de la constante d'acidité (donnée) permettra de montrer la spontanéité de cette transformation.
2.4. La méthode Dornic consiste à titrer 10,0 mL de lait par une solution aqueuse d'hydroxyde de sodium de concentration en quantité de matière 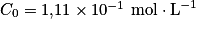 . On note
. On note 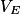 le volume de solution titrante versée à l'équivalence. On modélise la transformation chimique mise en jeu lors de ce titrage par une réaction support dont l'équation est la suivante :
le volume de solution titrante versée à l'équivalence. On modélise la transformation chimique mise en jeu lors de ce titrage par une réaction support dont l'équation est la suivante :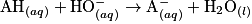 . On applique la méthode Dornic à un lait en utilisant le chou rouge comme indicateur coloré. Le pH initial vaut 5,9 et le pH à l'équivalence vaut 8,3. Le volume versé à l'équivalence est égal à 2,8 mL.
. On applique la méthode Dornic à un lait en utilisant le chou rouge comme indicateur coloré. Le pH initial vaut 5,9 et le pH à l'équivalence vaut 8,3. Le volume versé à l'équivalence est égal à 2,8 mL.
Justifier que le jus de chou rouge peut être utilisé pour repérer l'équivalence de ce titrage et préciser le changement de couleur du milieu.
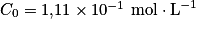 . On note
. On note 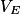 le volume de solution titrante versée à l'équivalence. On modélise la transformation chimique mise en jeu lors de ce titrage par une réaction support dont l'équation est la suivante :
le volume de solution titrante versée à l'équivalence. On modélise la transformation chimique mise en jeu lors de ce titrage par une réaction support dont l'équation est la suivante :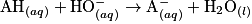 . On applique la méthode Dornic à un lait en utilisant le chou rouge comme indicateur coloré. Le pH initial vaut 5,9 et le pH à l'équivalence vaut 8,3. Le volume versé à l'équivalence est égal à 2,8 mL.
. On applique la méthode Dornic à un lait en utilisant le chou rouge comme indicateur coloré. Le pH initial vaut 5,9 et le pH à l'équivalence vaut 8,3. Le volume versé à l'équivalence est égal à 2,8 mL. Justifier que le jus de chou rouge peut être utilisé pour repérer l'équivalence de ce titrage et préciser le changement de couleur du milieu.
Pour qu'une espèce chimique soit utilisée comme indicateur coloré lors d'un titrage acido-basique, il faut que le pH à l'équivalence soit compris dans la zone de virage de l'indicateur coloré. Déterminez à quelle zone de virage appartient ce pH à l'équivalence et, ainsi, le changement de couleur dû au changement de forme de la cyanine.
2.5. En détaillant le raisonnement, déterminer si l'acidité Dornic du lait fermenté testé permet la fabrication d'un yaourt.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n'a pas abouti. La démarche est évaluée et nécessite d'être correctement présentée.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n'a pas abouti. La démarche est évaluée et nécessite d'être correctement présentée.
Avec l'équation de la réaction support du titrage, déterminez la relation qui lie les quantités de matière des réactifs à l'équivalence. Calculez ensuite la concentration molaire, puis la concentration massique de l'acide lactique et, enfin, le degré Dornic du lait.
Annexes
© 2000-2025, Miscellane

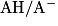 et
et 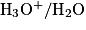 .
.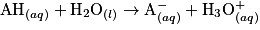
![\textrm{Q}_{ri} = \frac{\left[ A_{(aq)}^{-} \right]_{i} \left[\textrm{H}_{3} \textrm{O}_{(aq)}^{+}\right]_{i}}{\left[ \textrm{AH}_{( aq )}\right]_{i}} = 0](https://static1.assistancescolaire.com/t/images/t_speph_rde17_m9.png) , car à l'état initial
, car à l'état initial ![\left[A_{( aq )}^{-} \right]_{i} =0](https://static1.assistancescolaire.com/t/images/t_speph_rde17_m10.png) .
.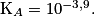 Donc la réaction évolue dans le sens direct.
Donc la réaction évolue dans le sens direct.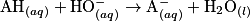
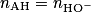 . On obtient donc, en isolant la concentration :
. On obtient donc, en isolant la concentration :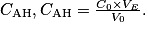 .
. 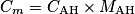 , soit
, soit 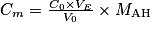 . Numériquement, on trouve
. Numériquement, on trouve 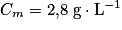 .
.  . Le degré Dornic du lait vaut donc 28 °D, ce qui est inférieur à 80 °D. Le lait ne permettra pas la fabrication d'un yaourt.
. Le degré Dornic du lait vaut donc 28 °D, ce qui est inférieur à 80 °D. Le lait ne permettra pas la fabrication d'un yaourt.