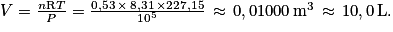Décrire un système thermodynamique : exemple du modèle du gaz parfait
Énoncé
Exercice 1
Les bouteilles de plongée ont été inventées en 1839 par Alexander McAvity et James Elliot au Canada. Elles sont couramment utilisées aujourd'hui dans le cadre d'activités de plongée sous-marine. Ces bouteilles sont fabriquées à partir d'acier ou d'alliages d'aluminium et contiennent un mélange de gaz, généralement de l'air, comprimé à des pressions allant de 150 à 450 bar.
On étudie dans cet exercice le contenu d'une bouteille de plongée de 12 litres à 230 bar de pression et à la température ambiante de 20 °C.
On étudie dans cet exercice le contenu d'une bouteille de plongée de 12 litres à 230 bar de pression et à la température ambiante de 20 °C.
1. Décrire le modèle du gaz parfait. Dans la suite, on considérera l'air comme étant un gaz parfait.
2. Déterminer la quantité de matière n contenue dans la bouteille de plongée étudiée.
3.
On considère l'air comme un mélange constitué d'une fraction molaire 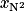 de diazote d'environ 79 %, et d'une fraction molaire
de diazote d'environ 79 %, et d'une fraction molaire 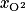 de dioxygène valant 21 %.
de dioxygène valant 21 %.
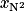 de diazote d'environ 79 %, et d'une fraction molaire
de diazote d'environ 79 %, et d'une fraction molaire 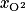 de dioxygène valant 21 %.
de dioxygène valant 21 %.a. Calculer la masse molaire moléculaire du diazote et du dioxygène, puis la masse molaire de l'air.
b. En déduire la masse d'air en kilogramme contenu dans la bouteille.
Données : Masses molaires atomiques :
Données : Masses molaires atomiques :
• oxygène :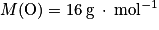 ;
;
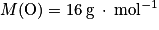 ;
;• azote : 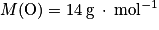 .
.
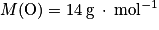 .
.Constante des gaz parfaits : 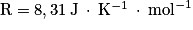 .
.
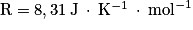 .
.La bonne méthode
1. C'est une définition du cours.2. Ici, il faut utiliser la loi des gaz parfaits.
3. La masse molaire d'une molécule correspond à la somme des masses molaires des atomes qui la compose. De même, pour un mélange comme l'air, on a
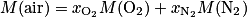 Utiliser la définition de la masse molaire, qui relie la masse et la quantité de matière d'un matériau.
Utiliser la définition de la masse molaire, qui relie la masse et la quantité de matière d'un matériau.Exercice 2
Les liquides frigorifiques sont utilisés dans l'industrie pour des applications de froid commercial : chambres froides, réfrigérateurs, etc. On s'intéresse ici à l'un d'entre eux, le fréon R404A.
Le fréon R404A (appellation commerciale) est un fluide frigorifique de la famille des hydrofluocarbures (corps composés d'hydrogène, de fluor et de carbone). Ces corps ne présentent pas de danger pour la couche d'ozone, car ils ne contiennent pas de chlore, mais ils peuvent avoir un impact sur l'effet de serre.
Le fréon R404A (appellation commerciale) est un fluide frigorifique de la famille des hydrofluocarbures (corps composés d'hydrogène, de fluor et de carbone). Ces corps ne présentent pas de danger pour la couche d'ozone, car ils ne contiennent pas de chlore, mais ils peuvent avoir un impact sur l'effet de serre.
1. Calculer la masse molaire du fréon R404A, de formule brute C4H9F4.
2. On considère une masse m = 7 × 10−1kg de fréon. Calculer la quantité de matière de fréon correspondante.
3.
Dans la suite de l'exercice, le comportement du fréon est assimilé à celui d'un gaz parfait. On considère une bouteille de fréon R404A à l'état gazeux, sous une pression de 1 bar, à la température T de −46 °C.
Quel est le volume de cette bouteille ?
Données :
Masses molaires atomiques :
Quel est le volume de cette bouteille ?
Données :
Masses molaires atomiques :
• carbone : 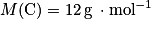 ;
;
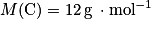 ;
;• hydrogène : 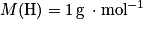 ;
;
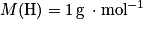 ;
;• fluor : 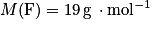 ;
;
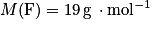 ;
;• constante des gaz parfaits : 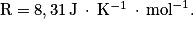
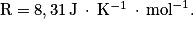
La bonne méthode
1. Utiliser la relation entre la masse molaire de la molécule et celle des atomes qui la compose.2. Utiliser la relation entre la masse, la quantité de matière et la masse molaire.
3. Utiliser la loi des gaz parfaits.
Annexes
© 2000-2025, Miscellane
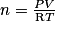 avec :
avec :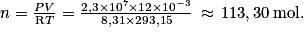
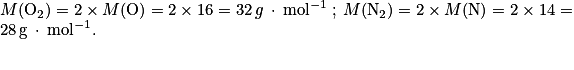
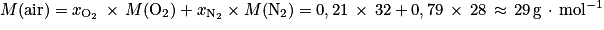
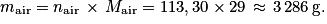
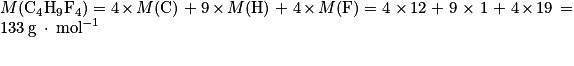
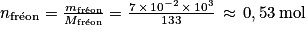
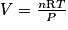 , avec T = −46 + 273,15 = 227,15 K ; P = 1 bar = 105 Pa et n = 0,53 mol.
, avec T = −46 + 273,15 = 227,15 K ; P = 1 bar = 105 Pa et n = 0,53 mol.