Prévoir le sens de l'évolution spontanée d'un système chimique et forcer son sens d'évolution
Énoncés
Exercice 1 (Antilles, 2006)
On étudie une réaction d'estérification dont l'équation s'écrit : A(l) + B(l) = E(l) +H2O(l).
À noter qu'un catalyseur, l'acide sulfurique, est ajouté au mélange en quantité négligeable pour accélérer la réaction.
À noter qu'un catalyseur, l'acide sulfurique, est ajouté au mélange en quantité négligeable pour accélérer la réaction.
1. On associe à cette réaction la constante d'équilibre K = 3,7. Donner l'expression de K.
2. À l'instant t1 = 4 min, la composition du système chimique est la suivante : [A(l)] = 0,255 mol, [B(l)] = 0,255 mol, [E(l)] = 0,125 mol, [H2O(l)] = 0,125 mol. Calculer le quotient de réaction Qr du mélange.
3. Dans quel sens va évoluer la réaction ?
La bonne méthode
1. Se souvenir de la définition de la constante d'équilibre. Attention, l'eau n'est pas en excès ici !
2. Utiliser la définition du quotient de réaction.
3. Comparer K et Qr, puis conclure.
Exercice 2 (adaptation Antilles, 2003)
On réalise une pile formée à partir des couples Ni2+/Ni et Zn2+/Zn. Chaque solution a pour volume V = 100 mL, et la concentration initiale des ions positifs est 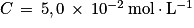 . L'électrode positive de cette pile est l'électrode de nickel. Le schéma du montage est le suivant :
. L'électrode positive de cette pile est l'électrode de nickel. Le schéma du montage est le suivant :
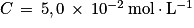 . L'électrode positive de cette pile est l'électrode de nickel. Le schéma du montage est le suivant :
. L'électrode positive de cette pile est l'électrode de nickel. Le schéma du montage est le suivant : |
Données :
• charge élémentaire de l'électron : e = 1,6 × 10−19 C ;
• nombre d'Avogadro NA = 6,02 × 1023 mol−1.
1.
a. Écrire les deux demi-équations de réaction. Préciser à chaque électrode s'il s'agit d'une oxydation ou d'une réduction.
b. Écrire la réaction globale spontanée. Combien d'électrons sont échangés ?
2. La réaction étant considérée comme totale, calculer l'avancement maximal xmax de la réaction.
3. En déduire la capacité électrique maximale de la pile.
4. On réalise une électrolyse de la pile, totalement déchargée, à l'aide d'un générateur de courant d'intensité I = 1,5 A. Combien de temps faudrait-il en théorie pour recharger entièrement la pile ?
La bonne méthode
1.
a. Chaque demi-équation fait intervenir l'oxydant et le réducteur d'un couple ainsi que des électrons pour la conservation de la charge. Se souvenir que l'électrode positive de la pile est l'électrode de nickel.
b. Additionner les deux demi-équations, l'espèce réduite et celle oxydée étant à gauche de l'équation de réaction (ce sont les réactifs).
2. La quantité de matière présente dans les électrodes étant beaucoup élevée que celle des réactifs présents en solution, le réactif limitant est forcément ionique.
3. On se souviendra de la relation entre la capacité maximale d'une pile, son avancement maximal, et le nombre d'électrons échangés par réaction.
4. Appliquer la relation entre la capacité maximale d'une pile et le courant qui circule à l'intérieur.
Annexes
© 2000-2025, Miscellane
![\mathrm{K}\, = \frac{[\mathrm{E}_{(l)}]_{\acute{e}q}\, \times \, [\mathrm{H}_{2}\mathrm{O}_{(l)}]_{\acute{e}q}}{[\mathrm{A}_{(l)}]_{\acute{e}q}\, \times \, [\mathrm{B}_{(l)}]_{\acute{e}q}}](https://static1.assistancescolaire.com/t/images/t_speph_rde05_m2.png) , où [ ]éq signifie la concentration à l'état d'équilibre.
, où [ ]éq signifie la concentration à l'état d'équilibre.![Q_{r}\, = \, \frac{[\mathrm{E}_{(l)}]\,\times \, [\mathrm{H}_{2}\mathrm{O}_{(l)}]}{[\mathrm{A}_{(l)}]\, \times \, [\mathrm{B}_{(l)}]}\, = \, \frac{0,125\,\times \, 0,125}{0,255\, \times \, 0,255}\, \approx \, 0,240](https://static1.assistancescolaire.com/t/images/t_speph_rde05_m3.png) .
.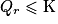 , ce qui signifie que la réaction va évoluer spontanément dans le sens direct, c'est-à-dire que la quantité de réactifs va diminuer alors que celles des produits va augmenter.
, ce qui signifie que la réaction va évoluer spontanément dans le sens direct, c'est-à-dire que la quantité de réactifs va diminuer alors que celles des produits va augmenter.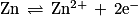
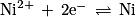
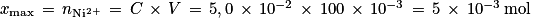 .
.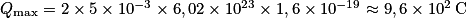 .
.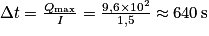 , soit 10 min 40 s.
, soit 10 min 40 s.