Modéliser l'évolution temporelle d'un système, siège d'une transformation chimique
Énoncé
Exercice 1 (Asie, juin 2013)
Deux mélanges eau/acétone sont étudiés à différentes températures. L'eau est ici en large excès, elle intervient donc comme solvant et comme réactif. Les conditions opératoires sont résumées dans le tableau ci-dessous :
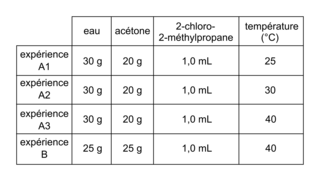 |
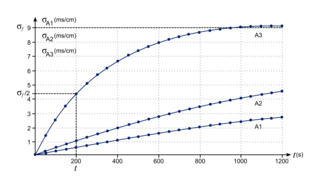
Le mélange eau/acétone est introduit dans un bécher de 100 mL qui est placé dans un bain thermostaté. Lorsque la température à l'intérieur du bécher est stabilisée à la valeur désirée, une sonde conductimétrique est introduite, puis 1,0 mL de 2-chloro-2-méthylpropane est versé dans le milieu réactionnel sous agitation. Au bout de quelques secondes, l'agitation est stoppée, puis la conductivité de la solution est suivie au cours du temps à l'aide d'un système informatisé. La durée de l'acquisition est de 20 minutes pour chaque étude. On suppose que 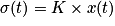 où σ(t) représente la conductivité de la solution à un instant donné à laquelle a été retranchée la conductivité initiale de la solution ; K est une constante qui va dépendre du mélange considéré et de la température ; x(t) représente l'avancement de la réaction à un instant donné. Les graphes ci-après représentent σ(t) en fonction du temps pour différentes conditions expérimentales.
où σ(t) représente la conductivité de la solution à un instant donné à laquelle a été retranchée la conductivité initiale de la solution ; K est une constante qui va dépendre du mélange considéré et de la température ; x(t) représente l'avancement de la réaction à un instant donné. Les graphes ci-après représentent σ(t) en fonction du temps pour différentes conditions expérimentales.
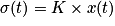 où σ(t) représente la conductivité de la solution à un instant donné à laquelle a été retranchée la conductivité initiale de la solution ; K est une constante qui va dépendre du mélange considéré et de la température ; x(t) représente l'avancement de la réaction à un instant donné. Les graphes ci-après représentent σ(t) en fonction du temps pour différentes conditions expérimentales.
où σ(t) représente la conductivité de la solution à un instant donné à laquelle a été retranchée la conductivité initiale de la solution ; K est une constante qui va dépendre du mélange considéré et de la température ; x(t) représente l'avancement de la réaction à un instant donné. Les graphes ci-après représentent σ(t) en fonction du temps pour différentes conditions expérimentales.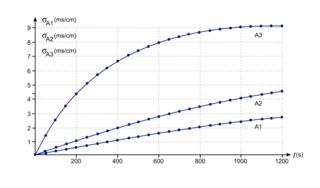 |
1. En comparant les expériences A1, A2 et A3, et en justifiant brièvement, indiquer l'influence de la température sur la vitesse de la réaction.
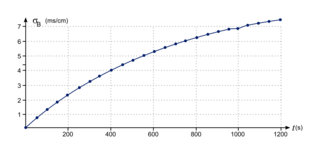
2. En comparant A3 et B, indiquer l'influence de la proportion eau/acétone sur la vitesse de la réaction chimique. Justifier la réponse.
 |
3. Définir le temps de demi-réaction.
4. Donner la valeur du temps de demi-réaction dans le cas de l'expérience A3.
5. On définit la vitesse molaire d'un composé A comme étant 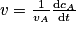 , avec CA la concentration du composé et vA son coefficient stochiométrique algébrique (constante).
, avec CA la concentration du composé et vA son coefficient stochiométrique algébrique (constante).
On dit qu'une réaction est de premier ordre si la vitesse suit la loi : v = k × cA, avec k une constante positive (attention :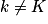 ).
).
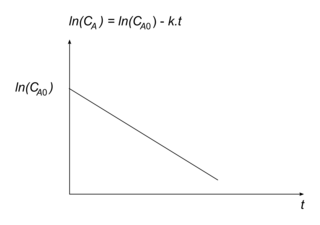
Supposons que l'expérience A3 suive une loi de vitesse d'ordre 1. On définit cA comme étant la concentration en acétone au cours de la réaction A3,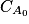 cette concentration au temps t = 0. Quelle serait l'allure de la courbe ln(cA) en fonction du temps. Justifier.
cette concentration au temps t = 0. Quelle serait l'allure de la courbe ln(cA) en fonction du temps. Justifier.
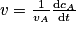 , avec CA la concentration du composé et vA son coefficient stochiométrique algébrique (constante).
, avec CA la concentration du composé et vA son coefficient stochiométrique algébrique (constante).On dit qu'une réaction est de premier ordre si la vitesse suit la loi : v = k × cA, avec k une constante positive (attention :
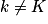 ).
).Supposons que l'expérience A3 suive une loi de vitesse d'ordre 1. On définit cA comme étant la concentration en acétone au cours de la réaction A3,
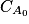 cette concentration au temps t = 0. Quelle serait l'allure de la courbe ln(cA) en fonction du temps. Justifier.
cette concentration au temps t = 0. Quelle serait l'allure de la courbe ln(cA) en fonction du temps. Justifier.La bonne méthode
1. Se reporter aux conditions initiales de chaque expérience et à la conductivité à une date donnée.2. Noter le rapport entre la proportion d'eau et d'acétone dans chaque expérience, puis analyser la conductivité pour une date donnée.
3. Définir le temps de demi-réaction.
4. Déterminer le temps de demi-réaction sur la courbe de A3.
5. L'évolution de ln(cA) en fonction du temps pour une loi de vitesse d'ordre 1 a été étudiée en cours. On peut la retrouver à partir de l'équation v = k × cA.
Exercice 2 (Métropole, juin 2013)
L'uréase est une enzyme isolée par James B. Summer en 1926. Elle joue un rôle important au sein des organismes vivants dans la décomposition d'une molécule organique, l'urée. On trouve l'uréase dans des organismes végétaux (comme le haricot sabre) mais également dans des bactéries pathogènes (telles que Helicobacter pylori).
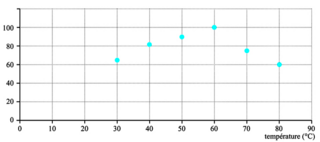
Document 1. Influence de la température sur l'activité enzymatique.
« La cinétique de la réaction catalysée est directement liée à l'activité de l'uréase : plus l'activité est grande, plus la réaction est rapide. L'activité relative, représentée sur le graphe ci-dessous, est le rapport de l'activité de l'enzyme sur son activité maximale, dans des conditions fixées de température, de pH et pour une quantité d'enzyme donnée. Condition expérimentale : pH = 7,0 (solution tampon au phosphate, de concentration molaire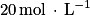 ). »
). »Document 2. Activité relative (en pourcentage) de l'uréase en fonction de la température.
 |
L'urée NH2 – CO – NH2. réagit avec l'eau pour former de l'ammoniac NH3 et du dioxyde de carbone. Au laboratoire, on réalise deux expériences :
• On dissout de l'urée dans de l'eau. Aucune réaction ne semble avoir lieu. Le temps de demi-réaction est estimé à 60 ans.
• On dissout de l'urée dans de l'eau en présence d'uréase. Il se forme quasi immédiatement les produits attendus. Le temps de demi-réaction vaut 2 × 10−5 s.
L'équation de la réaction s'écrit : NH2 – CO – NH2(aq) + H2O(l) → 2 NH3(aq) + CO2(g).
1. En quoi les résultats des expériences permettent-ils de considérer l'uréase comme un catalyseur ?
2. Effet de la température sur l'activité enzymatique.
a. Quelle est en général l'influence de la température sur la cinétique d'une réaction chimique ?
b. En utilisant le document 1, décrire l'influence de la température sur la cinétique de la réaction catalysée.
La bonne méthode
1. Comparer le temps de demi-réaction en présence et en absence d'uréase.2.a. Question de cours.
b. Décrire l'évolution de l'activité relative en fonction de la température et en déduire celle de la vitesse de la réaction.
Annexes
© 2000-2025, Miscellane
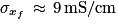 . Donc le temps de demi-réaction correspond au temps au bout duquel la conductivité atteint la valeur
. Donc le temps de demi-réaction correspond au temps au bout duquel la conductivité atteint la valeur 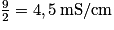 . On trouve
. On trouve 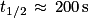 .
.
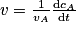 , avec v = k × cA. En résolvant cette équation différentielle (ou en utilisant directement le résultat du cours), on a
, avec v = k × cA. En résolvant cette équation différentielle (ou en utilisant directement le résultat du cours), on a 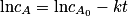 .
.