Énoncé
Exercice 1
La formule semi-développée de l'acide lactique est la suivante :
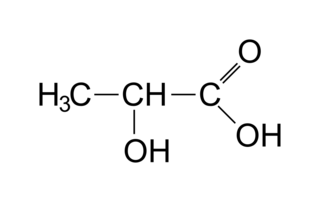 |
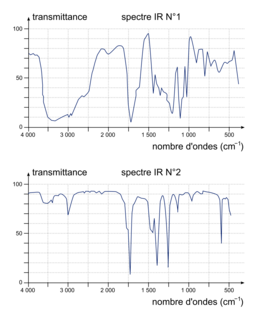
1. Parmi les spectres IR proposés dans le document ci-après, choisir en justifiant celui correspondant à l'acide lactique.
2. Prévoir, en justifiant la réponse, le nombre de signaux présents dans le spectre RMN de l'acide lactique ainsi que leur multiplicité.
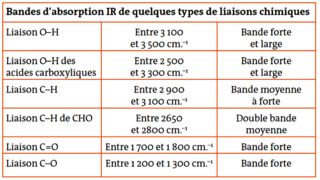
Donnée : bandes d'absorption en spectroscopie IR :
Donnée : bandes d'absorption en spectroscopie IR :
 |
Document
 |
La bonne méthode
1. Chercher les bandes d'absorption des groupes caractéristiques de la molécule.2. Séparer les hydrogènes en groupes de protons équivalents, puis analyser le nombre de voisins pour connaître la multiplicité des pics.
Exercice 2 (d'après Polynésie, 2014)
L'acide citrique est un acide organique présent en particulier dans les agrumes. Produit à près de deux millions de tonnes par an dans le monde, ses usages sont multiples, notamment dans l'agro-alimentaire et dans l'industrie des cosmétiques, mais aussi dans les produits ménagers.
On lit sur l'étiquette d'un sachet de détartrant à destination des cafetières ou des bouilloires :
« Détartrant poudre : élimine le calcaire déposé dans les tuyaux de la machine. Formule :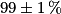 acide citrique, non corrosif pour les parties métalliques. Contenance : 40,0 g. »
acide citrique, non corrosif pour les parties métalliques. Contenance : 40,0 g. »
Afin de vérifier l'indication de l'étiquette du détartrant, on dissout le contenu d'un sachet dans un volume d'eau distillée égal à 2,00 L. La solution ainsi obtenue est notée S. On réalise alors le titrage pH-métrique d'une prise d'essai VA = 10,0 mL de la solution S par une solution aqueuse d'hydroxyde de sodium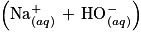 , de concentration molaire
, de concentration molaire 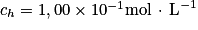 .
.
L'acide citrique étant un triacide, il est noté AH3. L'équation de la réaction, support du titrage, est la suivante :
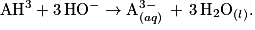
On lit sur l'étiquette d'un sachet de détartrant à destination des cafetières ou des bouilloires :
« Détartrant poudre : élimine le calcaire déposé dans les tuyaux de la machine. Formule :
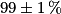 acide citrique, non corrosif pour les parties métalliques. Contenance : 40,0 g. »
acide citrique, non corrosif pour les parties métalliques. Contenance : 40,0 g. »Afin de vérifier l'indication de l'étiquette du détartrant, on dissout le contenu d'un sachet dans un volume d'eau distillée égal à 2,00 L. La solution ainsi obtenue est notée S. On réalise alors le titrage pH-métrique d'une prise d'essai VA = 10,0 mL de la solution S par une solution aqueuse d'hydroxyde de sodium
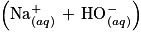 , de concentration molaire
, de concentration molaire 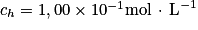 .
.L'acide citrique étant un triacide, il est noté AH3. L'équation de la réaction, support du titrage, est la suivante :
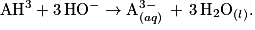
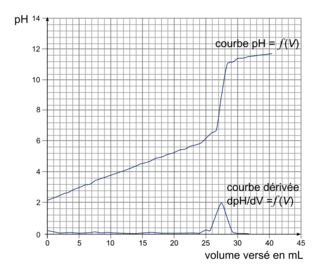
1. À partir de l'exploitation de la courbe de titrage pH-métrique, déterminer la concentration molaire d'acide citrique de la solution titrée.
2. Calculer le pourcentage en masse, noté p, d'acide citrique dans le sachet de détartrant. Le résultat obtenu pour le pourcentage en masse p est-il en cohérence avec l'étiquette ? On appelle pourcentage en masse le ratio entre la masse d'acide citrique et la masse totale du produit, en %.
Donnée : masse molaire de l'acide citrique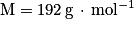 .
.
Donnée : masse molaire de l'acide citrique
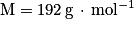 .
. |
La bonne méthode
1. Commencer par trouver le volume à l'équivalence Veq en utilisant la courbe dpH/dV = f(V), puis utiliser le fait qu'à l'équivalence, les réactifs sont présents en proportions stochiométriques.2. Traduire formellement la notion de pourcentage de masse, puis utiliser la relation entre la masse et la quantité de matière et celle entre la concentration et la quantité de matière pour trouver le résultat recherché.
Corrigé
Exercice 1
1. On note sur le spectre n°1 :
• une bande large entre 3 200 et 3 700 cm−1, caractéristique du groupe hydroxyle −OH ;
• une bande fine vers 1 750 cm−1, caractéristique du groupe carbonyle C = O.
Sur le spectre n°2 : seule la bande fine est présente vers 1 750 cm−. Comme l'acide lactique possède des groupes OH, le spectre n° 1 correspond à l'acide lactique.
2. Le nombre de signaux est égal au nombre de groupe de protons équivalents.
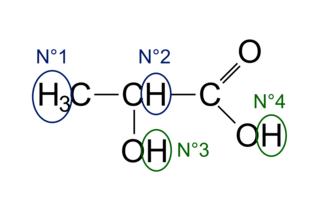 |
On note quatre groupes de protons équivalents dans la molécule :
• le n°1 sera un doublet, car il a 1 voisin ;
• le n°2 sera un quadruplet, car il a 3 voisins (le H du groupement OH n'intervient pas) ;
• les n°3 et n°4 seront des singulets puisqu'il n'y a pas de couplage dans les groupements OH.
Exercice 2
1. On utilise la courbe de titrage pH-métrique pour trouver le volume d'hydroxyde versé à l'équivalence, noté Véq Celui-ci correspond à l'abscisse du point correspondant au maximum de la dérivée 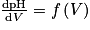 . On trouve
. On trouve 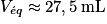 .
.
(On aurait pu également utiliser la méthode des tangentes.)
Les réactifs étant présent en proportions stochiométriques à l'équivalence, on déduit de l'équation du dosage que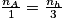 , avec nA la quantité de matière d'acide et nh la quantité de matière d'hydroxyde.
, avec nA la quantité de matière d'acide et nh la quantité de matière d'hydroxyde.
Ainsi, on a :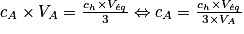 où CA est la concentration en acide recherchée.
où CA est la concentration en acide recherchée.
Donc la concentration d'acide citrique est :
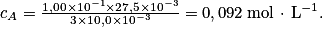
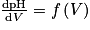 . On trouve
. On trouve 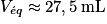 .
.(On aurait pu également utiliser la méthode des tangentes.)
Les réactifs étant présent en proportions stochiométriques à l'équivalence, on déduit de l'équation du dosage que
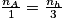 , avec nA la quantité de matière d'acide et nh la quantité de matière d'hydroxyde.
, avec nA la quantité de matière d'acide et nh la quantité de matière d'hydroxyde.Ainsi, on a :
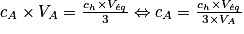 où CA est la concentration en acide recherchée.
où CA est la concentration en acide recherchée.Donc la concentration d'acide citrique est :
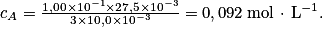
2. Le pourcentage en masse s'écrit 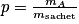 , avec mA la masse d'acide dans le sachet, dissout dans V = 2L d'eau.
, avec mA la masse d'acide dans le sachet, dissout dans V = 2L d'eau.
Or mA = n A× V = c A× M × V = 0,092 × 192 × 2,00 = 35,328 g
Donc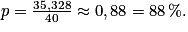
Le sachet indique un pourcentage de masse de 99 %, avec une incertitude de 1 %, ce qui n'est pas cohérent avec le résultat obtenu.
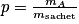 , avec mA la masse d'acide dans le sachet, dissout dans V = 2L d'eau.
, avec mA la masse d'acide dans le sachet, dissout dans V = 2L d'eau.Or mA = n A× V = c A× M × V = 0,092 × 192 × 2,00 = 35,328 g
Donc
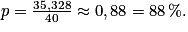
Le sachet indique un pourcentage de masse de 99 %, avec une incertitude de 1 %, ce qui n'est pas cohérent avec le résultat obtenu.

