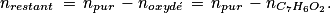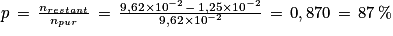Modéliser des transformations acide-base
Énoncés
Exercice 1 (Liban, juin 2014)
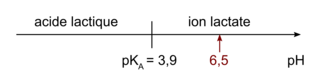
En solution aqueuse, l'acide lactique, que l'on notera HA, a des propriétés acido-basiques. Sa base conjuguée est l'ion lactate.
Donnée : pKA (acide lactique/ion lactate) = 3,9.
Donnée : pKA (acide lactique/ion lactate) = 3,9.
1. Le pH une solution d'acide lactique de concentration molaire 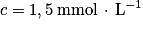 est égal à 3,4. L'acide lactique est-il un acide fort ou faible ?
est égal à 3,4. L'acide lactique est-il un acide fort ou faible ?
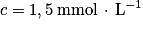 est égal à 3,4. L'acide lactique est-il un acide fort ou faible ?
est égal à 3,4. L'acide lactique est-il un acide fort ou faible ?2. Le pH d'un lait frais se situe autour de 6,5. Quelle est l'espèce prédominante du couple acide lactique/ion lactate ? Justifier la réponse.
La bonne méthode
1. Si l'acide lactique était un acide fort, on utiliserait une relation particulière pour calculer son pH.2. Tracer le diagramme de prédominance du couple et en déduire l'espèce prédominante pour un pH de 6,5.
Exercice 2 (Amérique du Sud, juin 2016)
Le benzaldéhyde est un liquide incolore, couramment utilisé comme additif alimentaire pour son odeur d'amande amère. Le benzaldéhyde étant susceptible de s'oxyder en acide benzoïque lorsque le flacon est entamé, il convient de vérifier sa pureté avant de l'utiliser comme réactif. L'élève cherche à déterminer quantitativement la pureté du benzaldéhyde dans le flacon entamé. Pour cela, il réalise le titrage de 10,0 mL de solution prélevée dans le flacon de benzaldéhyde par une solution aqueuse d'hydroxyde de sodium 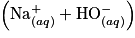 de concentration molaire
de concentration molaire 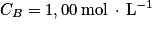
Données :
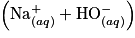 de concentration molaire
de concentration molaire 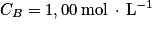
Données :
• l'acide benzoïque appartient au couple 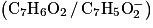
• benzaldéhyde : masse molaire moléculaire 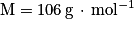 masse volumique
masse volumique 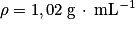
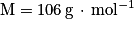 masse volumique
masse volumique 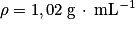
• pureté d'un réactif : 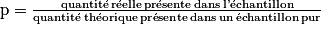
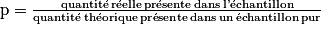
• zone de virage de quelques indicateurs colorés :
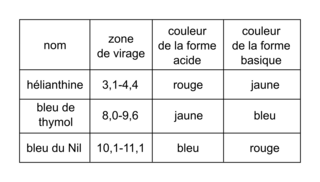 |
1.
Écrire l'équation de la réaction support de titrage entre l'acide benzoïque et les ions hydroxyde. Le titrage étant suivi par pH-métrie, l'élève a tracé la courbe pH = f(V) et la courbe « dérivée de pH » en fonction de V.
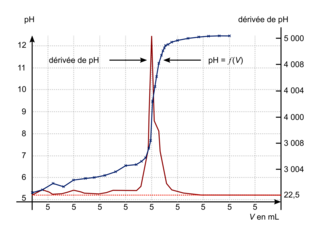 |
2. Déterminer la quantité de matière d'acide benzoïque présente dans le volume de solution prélevée en explicitant la méthode utilisée à l'aide des graphiques donnés.
3. Déterminer la quantité de matière de benzaldéhyde présente dans 10,0 mL de benzaldéhyde pur.
4. En déduire la valeur de la pureté de la solution du flacon entamé de benzaldéhyde.
5. Expliquer quel indicateur coloré choisir si l'on souhaitait effectuer le même titrage à l'aide d'un suivi colorimétrique. Indiquer le changement de couleur qui permettrait alors de repérer l'équivalence.
La bonne méthode
1. C'est une réaction acido-basique entre l'acide benzoïque et l'ion hydroxyde.2. Avec la courbe de titrage, déterminer le volume à l'équivalence. Puis calculer la quantité d'ions hydroxyde introduits à l'équivalence. En déduire la quantité d'acide benzoïque.
3. Calculer la quantité théorique de benzaldéhyde dans 10,0 mL avec les données de l'énoncé.
4. Le benzaldéhyde s'oxyde en acide benzoïque. S'il était pur, la quantité d'acide benzoïque serait nulle. Déterminer la quantité de benzaldéhyde restant dans le flacon entamé, puis utiliser la relation de l'énoncé.
5. La zone de virage de l'indicateur coloré doit contenir le pH à l'équivalence.
Annexes
© 2000-2025, Miscellane
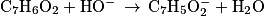
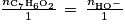
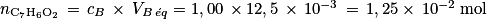
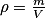 avec m = npur × M.
avec m = npur × M.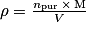 c'est-à-dire
c'est-à-dire 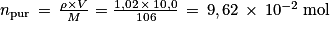
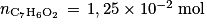 . Or la quantité d'acide benzoïque présent correspond à la quantité de benzaldéhyde qui a été oxydé. La quantité de benzaldéhyde restant dans le flacon est donc
. Or la quantité d'acide benzoïque présent correspond à la quantité de benzaldéhyde qui a été oxydé. La quantité de benzaldéhyde restant dans le flacon est donc