Analyser un système par des méthodes physiques et chimiques
Fiche
Analyser la composition d'un système, c'est notamment déterminer les espèces chimiques qu'il contient et leurs quantités. Les méthodes spectroscopiques, basées sur l'absorption d'énergie par une espèce chimique, permettent de connaître les espèces en présence dans la solution. Le dosage permet quant à lui de déterminer avec précision la concentration d'une espèce dans cette solution.
I. Comment identifier une espèce chimique par spectroscopie ?
Les méthodes de spectroscopie, que l'on appelle également analyse spectrale, permettent d'identifier des espèces chimiques en étudiant les interactions entre la matière et une onde électromagnétique. On accède ainsi à leur spectre d'absorption. On les classe selon le type de rayonnement utilisé.
La spectroscopie UV-visible met en jeu des rayonnements de longueur d'onde comprise entre 200 et 400 nm pour les rayonnements UV, et entre 400 et 800 nm pour les rayonnements visibles. L'absorption de ces radiations par un composé entraîne des transitions électroniques.
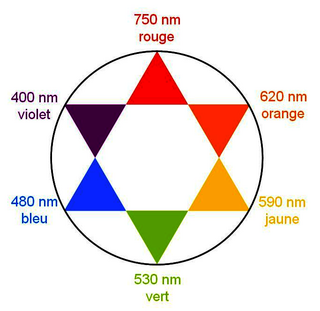
Un spectre UV-visible est constitué par la représentation de la variation de l'absorbance en fonction de la longueur d'onde λ. Si la valeur maximum de λ appartient au domaine du visible, le composé est coloré : sa couleur est la couleur complémentaire de la radiation qu'il absorbe (couleur diamétralement opposée sur le cercle chromatique).
La spectroscopie UV-visible met en jeu des rayonnements de longueur d'onde comprise entre 200 et 400 nm pour les rayonnements UV, et entre 400 et 800 nm pour les rayonnements visibles. L'absorption de ces radiations par un composé entraîne des transitions électroniques.
Un spectre UV-visible est constitué par la représentation de la variation de l'absorbance en fonction de la longueur d'onde λ. Si la valeur maximum de λ appartient au domaine du visible, le composé est coloré : sa couleur est la couleur complémentaire de la radiation qu'il absorbe (couleur diamétralement opposée sur le cercle chromatique).
 |
L'absorption est le plus souvent due à l'existence de doubles liaisons conjuguées. D'autres facteurs peuvent influer sur la couleur d'une molécule : présence de groupes caractéristiques, pH du milieu, solvant, etc.
La spectroscopie infrarouge (IR) met en jeu des rayonnements de longueur d'onde comprise entre 2,5 et 16 μm. L'absorption de ces radiations par une molécule correspond à des transitions vibrationnelles. Un spectre IR est constitué par la représentation des variations du pourcentage de transmission en fonction du nombre d'onde σ en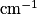 . On a
. On a 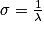 .
.
La spectroscopie RMN (résonance magnétique nucléaire) du proton exploite les transitions énergétiques des noyaux d'hydrogène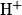 placés dans un champ électromagnétique et soumis à un rayonnement appartenant au domaine des radiofréquences, de longueur d'onde comprise entre
placés dans un champ électromagnétique et soumis à un rayonnement appartenant au domaine des radiofréquences, de longueur d'onde comprise entre 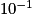 et
et 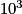 m. L'absorption d'une radiation de fréquence convenable conduit à une transition du niveau le plus bas vers le niveau le plus haut : ce phénomène est appelé résonance.
m. L'absorption d'une radiation de fréquence convenable conduit à une transition du niveau le plus bas vers le niveau le plus haut : ce phénomène est appelé résonance.
On introduit une grandeur indépendante de l'intensité du champ magnétique, appelée déplacement chimique δ (en ppm).
Les protons ayant des environnements différents résonnent à des fréquences différentes ; réciproquement, les protons possédant le même environnement chimique résonnent à la même fréquence et ont donc le même déplacement chimique : ils sont dits équivalents. La courbe d'intégration du spectre permet de déterminer le nombre de protons correspondant à chaque signal. Le nombre de signaux obtenus est égal au nombre de groupes de protons équivalents.
Lorsqu'un proton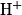 ou un groupe de protons équivalents possèdent n protons voisins équivalents et éloignés de 3 liaisons, le signal obtenu est constitué de (n + 1) pics appelés (n + 1) − uplet : singulet lorsqu'il n'y a pas de couplage, doublet quand il y a couplage avec un proton, triplet quand le couplage se fait avec deux protons, etc.
ou un groupe de protons équivalents possèdent n protons voisins équivalents et éloignés de 3 liaisons, le signal obtenu est constitué de (n + 1) pics appelés (n + 1) − uplet : singulet lorsqu'il n'y a pas de couplage, doublet quand il y a couplage avec un proton, triplet quand le couplage se fait avec deux protons, etc.
Les protons du groupe hydroxyle −OH ne présentent pas de couplage, du fait de l'échange rapide entre les molécules : ils apparaissent donc sous forme de singulets.
La spectroscopie infrarouge (IR) met en jeu des rayonnements de longueur d'onde comprise entre 2,5 et 16 μm. L'absorption de ces radiations par une molécule correspond à des transitions vibrationnelles. Un spectre IR est constitué par la représentation des variations du pourcentage de transmission en fonction du nombre d'onde σ en
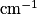 . On a
. On a 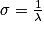 .
.La spectroscopie RMN (résonance magnétique nucléaire) du proton exploite les transitions énergétiques des noyaux d'hydrogène
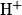 placés dans un champ électromagnétique et soumis à un rayonnement appartenant au domaine des radiofréquences, de longueur d'onde comprise entre
placés dans un champ électromagnétique et soumis à un rayonnement appartenant au domaine des radiofréquences, de longueur d'onde comprise entre 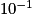 et
et 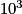 m. L'absorption d'une radiation de fréquence convenable conduit à une transition du niveau le plus bas vers le niveau le plus haut : ce phénomène est appelé résonance.
m. L'absorption d'une radiation de fréquence convenable conduit à une transition du niveau le plus bas vers le niveau le plus haut : ce phénomène est appelé résonance.On introduit une grandeur indépendante de l'intensité du champ magnétique, appelée déplacement chimique δ (en ppm).
Les protons ayant des environnements différents résonnent à des fréquences différentes ; réciproquement, les protons possédant le même environnement chimique résonnent à la même fréquence et ont donc le même déplacement chimique : ils sont dits équivalents. La courbe d'intégration du spectre permet de déterminer le nombre de protons correspondant à chaque signal. Le nombre de signaux obtenus est égal au nombre de groupes de protons équivalents.
Lorsqu'un proton
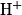 ou un groupe de protons équivalents possèdent n protons voisins équivalents et éloignés de 3 liaisons, le signal obtenu est constitué de (n + 1) pics appelés (n + 1) − uplet : singulet lorsqu'il n'y a pas de couplage, doublet quand il y a couplage avec un proton, triplet quand le couplage se fait avec deux protons, etc.
ou un groupe de protons équivalents possèdent n protons voisins équivalents et éloignés de 3 liaisons, le signal obtenu est constitué de (n + 1) pics appelés (n + 1) − uplet : singulet lorsqu'il n'y a pas de couplage, doublet quand il y a couplage avec un proton, triplet quand le couplage se fait avec deux protons, etc.Les protons du groupe hydroxyle −OH ne présentent pas de couplage, du fait de l'échange rapide entre les molécules : ils apparaissent donc sous forme de singulets.
II. Comment doser par étalonnage ?
Réaliser un dosage par étalonnage consiste à déterminer la concentration d'une espèce en solution par comparaison d'une propriété physique de l'échantillon (absorbance, conductivité, etc.) à celle de solutions étalons de concentration connue, grâce au tracé d'une courbe d'étalonnage :• si l'espèce à doser est colorée, la grandeur mesurée est l'absorbance, il s'agit d'un dosage spectrométrique ;
• si l'espèce à doser est un ion, la grandeur mesurée est la conductivité, il s'agit d'un dosage conductimétrique.
III. Comment doser par titrage ?
Réaliser un dosage par titrage direct consiste à déterminer la concentration de l'espèce à doser en la faisant intervenir dans une réaction chimique. Un volume précis (prise d'essai) de la solution titrée (espèce à doser) est placé dans un bécher, puis on ajoute progressivement la solution titrante de concentration connue, placée dans la burette. La réaction chimique se produisant entre les espèces titrante et titrée est appelée réaction support du titrage. Elle doit être totale, rapide et univoque (les réactifs ne doivent pas intervenir dans une autre réaction).Le suivi du titrage peut être réalisé de différentes façons :
• par conductimétrie, le changement du sens de variation de la courbe de conductivité indique l'équivalence ;
• par pH-métrie, la brusque variation du pH indique le point d'équivalence (c'est également le point où la dérivée de la fonction pH (V) est maximum) ;
• par suivi colorimétrique, le changement de couleur indique l'équivalence.
Exercice n°1
Exercice n°1
Zoom sur…
Dosage par titrage
L'équivalence d'un titrage correspond à l'état final du système chimique, pour lequel les réactifs (espèces titrée et titrante) ont été introduits en proportions stœchiométriques et sont donc entièrement consommés. Le volume total de solution titrante versée pour atteindre l'équivalence est appelé volume équivalent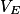 .
.Si l'équation de la réaction du dosage s'écrit a A + b B → c C + d D, alors à l'équivalence, on a
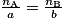 avec :
avec :• a, b, c et d, nombres stœchiométriques pour chaque espèce chimique ;
• A et B, les réactifs titré et titrant ;
• C et D, les produits de la réaction ;
• 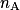 , la quantité de matière introduite initialement pour le réactif titré ;
, la quantité de matière introduite initialement pour le réactif titré ;
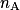 , la quantité de matière introduite initialement pour le réactif titré ;
, la quantité de matière introduite initialement pour le réactif titré ;• 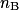 , la quantité de matière introduite à l'équivalence pour le réactif titrant.
, la quantité de matière introduite à l'équivalence pour le réactif titrant.
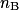 , la quantité de matière introduite à l'équivalence pour le réactif titrant.
, la quantité de matière introduite à l'équivalence pour le réactif titrant.Notions-clés
La loi de Beer-Lambert
La loi de Beer-Lambert permet de mesurer la concentration d'une solution colorée. Pour les solutions suffisamment diluées, l'absorbance (à longueur d'onde fixée) est proportionnelle à la concentration. On a A = k × c, avec :
• A, l'absorbance de la solution (sans unité) ;
• c, la concentration molaire de l'espèce colorée (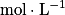 ) ;
) ;
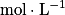 ) ;
) ;• k, le coefficient de proportionnalité (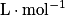 ).
).
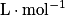 ).
).La loi de Kohlraush
La loi de Kohlraush permet de mesurer la concentration d'une solution conductrice. Elle relie la conductivité d'une solution à sa concentration en espèces ioniques. Elle s'écrit :
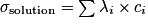 , avec :
, avec :
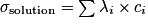 , avec :
, avec :• σ, la conductivité de la solution ;
• 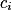 , la concentration de l'espèce i ;
, la concentration de l'espèce i ;
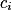 , la concentration de l'espèce i ;
, la concentration de l'espèce i ;• 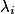 , la conductivité de l'espèce ionique i.
, la conductivité de l'espèce ionique i.
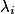 , la conductivité de l'espèce ionique i.
, la conductivité de l'espèce ionique i.© 2000-2024, rue des écoles