Sujet de métropole, juin 2024
Énoncé
Les essais et les démarches engagés, même non aboutis, seront pris en compte.
La France accueille cette année les Jeux olympiques et paralympiques durant lesquels trente-deux disciplines sportives seront à l'honneur.
Le seul équipement sportif construit pour l'occasion sera le centre aquatique, voisin du Stade de France, où se dérouleront les épreuves de natation artistique, de plongeon et de water-polo.
La France accueille cette année les Jeux olympiques et paralympiques durant lesquels trente-deux disciplines sportives seront à l'honneur.
Le seul équipement sportif construit pour l'occasion sera le centre aquatique, voisin du Stade de France, où se dérouleront les épreuves de natation artistique, de plongeon et de water-polo.
 |
Piscine et équilibre de l'eau
« Les recommandations du Comité international olympique spécifient une plage de pH idéale de 7,2 à 7,8 pour l'eau des bassins. Si le pH devient trop élevé, au-dessus de 8, la désinfection au « chlore » n'est plus efficace, et la formation de « calcaire » augmente. Si le pH de l'eau tombe en dessous de 7, le confort des baigneurs n'est plus assuré (irritations de la peau et des yeux) et la durée de vie des équipe-ments notamment métalliques est réduite. »
D'après le guide du CIO sur le sport, l'environnement et le développement durable et https://www.ars.sante.fr
Question 1 (2 points)
Donner les deux inconvénients d'une eau de piscine dont le pH est inférieur à 7.
Pour répondre à la question, il faut bien lire le texte proposé en introduction.
Le rouge de phénol, de formule chimique C19H14O5S, est un indicateur coloré. C'est une substance qui change de couleur en fonction du pH de la solution testée. Il est ainsi utilisé pour contrôler le pH des piscines. Le tableau ci-dessous indique ses zones de coloration dans l'échelle de pH.
D'après https://fr.wikipedia.org
Un agent de maintenance souhaite vérifier le pH de l'eau de la future piscine olympique. Il obtient une couleur rouge au résultat du test au rouge de phénol.
| Couleur du rouge de phénol | Jaune | Orange | Rouge |
| Zone de pH | Valeurs de pH comprises entre 0 et 6,6 | Valeurs de pH comprises entre 6,6 et 8,4 | Valeurs de pH comprises entre 8,4 et 14 |
Un agent de maintenance souhaite vérifier le pH de l'eau de la future piscine olympique. Il obtient une couleur rouge au résultat du test au rouge de phénol.
Question 2 (6 points)
a. Indiquer si l'eau de la piscine, testée par l'agent de maintenance, a un caractère acide, basique ou neutre. Justifier.
Pour répondre correctement à la question, il faut se servir du tableau ci-dessus et de vos connaissances sur les définitions de pH acide, basique et neutre qui ne sont pas données dans le texte.
b. Sachant que dans la formule de la molécule de rouge de phénol, le symbole S correspond à l'atome de soufre, donner le nom des autres atomes qui la constituent.
Appuyez-vous sur vos connaissances du tableau périodique des éléments.
Dans les centres nautiques, les équipements métalliques sont essentiellement en acier inoxydable. Ainsi, le fer (Fe) n'est pas recommandé car il subit de nombreuses transformations chimiques qui le fragilisent. L'équation de réaction chimique ci-dessous modélise l'action des ions H+, responsables de l'acidité, sur les atomes de fer :
Fe + 2 H+ → Fe2+ + H2
Fe + 2 H+ → Fe2+ + H2
Question 3 (3 points)
Citer parmi les formules chimiques des espèces présentes dans l'équation de réaction ci-dessus, la formule d'une molécule, celle d'un atome et celle d'un ion.
Il est apprécié de rappeler les définitions d'une molécule, d'un atome et d'un ion.
On peut réaliser des tests caractéristiques sur le milieu réactionnel pour mettre en évidence les produits de la réaction.
Banque de données de tests caractéristiques
| Test | Ion testé ou molécule testée | Observation |
| Test à la flamme | Dihydrogène | Détonation |
| Test à l'allumette incandescente | Dioxygène | L'allumette se rallume |
| Test à la soude | Ion Fe2+ | Précipité vert |
| Test à la soude | Ion Fe3+ | Précipité rouille |
Question 4 (2 points)
On a fait réagir du fer (Fe) avec les ions H+ dans un tube à essai.
En utilisant la banque de données ci-dessus et l'équation de réaction vue plus haut, écrire sur la copie les numéros des propositions correctes parmi les suivantes :
P1 : On observe un précipité vert lorsque l'on ajoute de la soude ;
P2 : On observe un précipité rouille lorsque l'on ajoute de la soude ;
P3 : On entend une détonation lorsque l'on approche une flamme ;
P4 : Lorsque l'on approche une allumette incandescente, elle se rallume.
En utilisant la banque de données ci-dessus et l'équation de réaction vue plus haut, écrire sur la copie les numéros des propositions correctes parmi les suivantes :
P1 : On observe un précipité vert lorsque l'on ajoute de la soude ;
P2 : On observe un précipité rouille lorsque l'on ajoute de la soude ;
P3 : On entend une détonation lorsque l'on approche une flamme ;
P4 : Lorsque l'on approche une allumette incandescente, elle se rallume.
Pour répondre à la question, il faut regarder les produits de la réaction : les ions Fe2+ et la molécule de dihydrogène H2.
Épreuve de plongeon à 10 mètres
Nous allons nous intéresser à la discipline du plongeon à 10 m. Des études ont permis de définir la tolérance du corps humain à un tel saut. Pour des raisons de sécurité, la fédération internationale de natation limite, en compétition, la vitesse atteinte lors du contact avec l'eau à 80 km/h environ.
 |
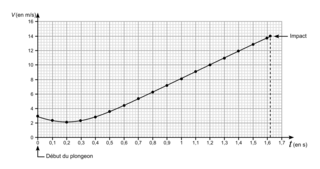 |
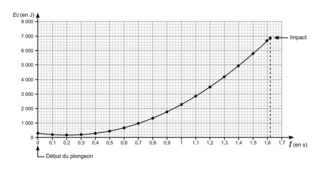
Question 5 (12 points)
a. Décrire l'évolution de l'énergie cinétique du plongeur au cours du temps.
b. Nommer la forme d'énergie qui est convertie en énergie cinétique au cours du plongeon.
Ici, la difficulté du sujet, c'est qu'il ne demande pas de comparer les deux courbes alors qu'il est nécessaire de le faire.
c. Indiquer la durée du plongeon en secondes, notée t1.
d. À l'aide des graphiques ci-dessus, déterminer si la vitesse au moment de l'impact, notée v1, permet de respecter la norme de sécurité sur la vitesse atteinte lors du contact avec l'eau. Toute démarche même partielle sera prise en compte.
Annexes
© 2000-2025, Miscellane