Équilibrer une équation de réaction chimique
Pour équilibrer une équation de réaction chimique, il faut s'assurer de placer les bons coefficients stœchiométriques devant les molécules de l'équation, pour qu'il y ait autant d'atomes à gauche qu'à droite de la flèche.
I. Réaction de combustion
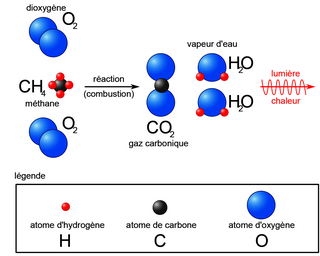 |
• Exemple avec la réaction de combustion complète du méthane : du méthane CH4 réagit avec du dioxygène O2 pour former du dioxyde de carbone CO2 et de la vapeur d'eau H2O. Équation provisoire : CH4 + O2 → CO2 + H2O.
Étape 1 : on pense à préciser les états physiques des différents constituants :
CH4(g) + O2(g) → CO2(g) + H2O(g)
Étape 1 : on pense à préciser les états physiques des différents constituants :
CH4(g) + O2(g) → CO2(g) + H2O(g)
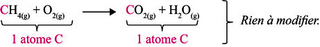 |
Étape 2 : on compte le nombre d'atomes de carbone à droite et à gauche de la flèche et on ajuste les coefficients stœchiométriques si besoin :
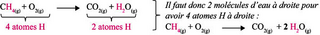 |
Étape 3 : on compte le nombre d'atomes d'hydrogène à droite et à gauche de la flèche et on ajuste les coefficients stœchiométriques si besoin :
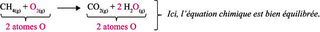 |
Étape 4 : on compte le nombre d'atomes d'oxygène à droite et à gauche de la flèche et on ajuste les coefficients stœchiométriques si besoin :
Étape 5 : on équilibre les charges quand cela est nécessaire.
II. Réaction entre un acide et un métal
• Le fer solide Fe(s) réagit avec l'acide chlorhydrique H+ (aq) + Cl − (aq) :
- test de l'allumette : on en déduit qu'il s'est formé du dihydrogène gazeux H2(g) au cours de la réaction ;
- test au nitrate d'argent : on en déduit la présence d'ions chlorure Cl − (aq);
- test à la soude : on en déduit la présence d'ions Fe2+ (aq).
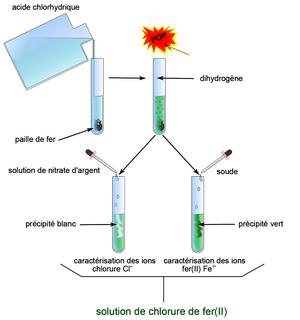 |
• Équation de la réaction :
Fe(s) + 2H+ (aq) + Cl − (aq) → H2(g) + Fe2+ (aq).+ Cl − (aq)
Remarque : on vérifie que les charges soient bien équilibrées : ici, 2 + à gauche de « → » et 2 + à droite : c'est bon !
Fe(s) + 2H+ (aq) + Cl − (aq) → H2(g) + Fe2+ (aq).+ Cl − (aq)
Remarque : on vérifie que les charges soient bien équilibrées : ici, 2 + à gauche de « → » et 2 + à droite : c'est bon !
• Les ions Cl − n'ont pas été transformés : on les appelle « ions spectateurs » et on peut se passer de les faire apparaître dans l'équation.
© 2000-2025, Miscellane