Signaler une erreur
Physique-chimie - Réviser une notion
Équilibrer une équation de réaction chimique
Physique-chimie - Réviser une notion
Équilibrer une équation de réaction chimique
Imprimer
Physique-chimie - Réviser une notion
Équilibrer une équation de réaction chimique
Physique-chimie - Réviser une notion
Équilibrer une équation de réaction chimique
Pour équilibrer une équation de réaction chimique, il faut s'assurer de placer les bons coefficients stœchiométriques devant les molécules de l'équation, pour qu'il y ait autant d'atomes à gauche qu'à droite de la flèche.
I. Réaction de combustion
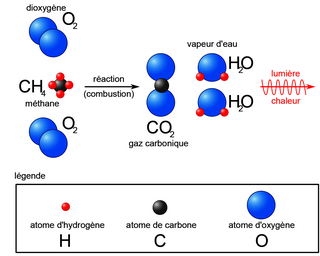 |
• Exemple avec la réaction de combustion complète du méthane : du méthane CH4 réagit avec du dioxygène O2 pour former du dioxyde de carbone CO2 et de la vapeur d'eau H2O. Équation provisoire : CH4 + O2 → CO2 + H2O.
Étape 1 : on pense à préciser les états physiques des différents constituants :
CH4(g) + O2(g) → CO2(g) + H2O(g)
Étape 1 : on pense à préciser les états physiques des différents constituants :
CH4(g) + O2(g) → CO2(g) + H2O(g)
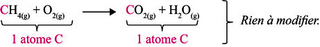 |
Étape 2 : on compte le nombre d'atomes de carbone à droite et à gauche de la flèche et on ajuste les coefficients stœchiométriques si besoin :
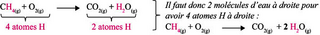 |
Étape 3 : on compte le nombre d'atomes d'hydrogène à droite et à gauche de la flèche et on ajuste les coefficients stœchiométriques si besoin :
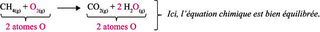 |
Étape 4 : on compte le nombre d'atomes d'oxygène à droite et à gauche de la flèche et on ajuste les coefficients stœchiométriques si besoin :
Étape 5 : on équilibre les charges quand cela est nécessaire.
II. Réaction entre un acide et un métal
• Le fer solide Fe(s) réagit avec l'acide chlorhydrique H+ (aq) + Cl − (aq) :
- test de l'allumette : on en déduit qu'il s'est formé du dihydrogène gazeux H2(g) au cours de la réaction ;
- test au nitrate d'argent : on en déduit la présence d'ions chlorure Cl − (aq);
- test à la soude : on en déduit la présence d'ions Fe2+ (aq).
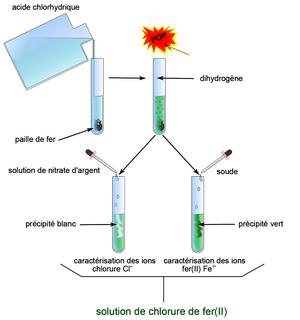 |
• Équation de la réaction :
Fe(s) + 2H+ (aq) + Cl − (aq) → H2(g) + Fe2+ (aq).+ Cl − (aq)
Remarque : on vérifie que les charges soient bien équilibrées : ici, 2 + à gauche de « → » et 2 + à droite : c'est bon !
Fe(s) + 2H+ (aq) + Cl − (aq) → H2(g) + Fe2+ (aq).+ Cl − (aq)
Remarque : on vérifie que les charges soient bien équilibrées : ici, 2 + à gauche de « → » et 2 + à droite : c'est bon !
• Les ions Cl − n'ont pas été transformés : on les appelle « ions spectateurs » et on peut se passer de les faire apparaître dans l'équation.
Signaler une erreur
Physique-chimie - Réviser une notion
Équilibrer une équation de réaction chimique
Physique-chimie - Réviser une notion
Équilibrer une équation de réaction chimique
Imprimer
Physique-chimie - Réviser une notion
Équilibrer une équation de réaction chimique
Physique-chimie - Réviser une notion
Équilibrer une équation de réaction chimique

