La transformation chimique
I. Différence entre transformation chimique et transformation physique
• Une transformation physique est le passage d'un corps d'une forme physique à une autre, sans modification de la nature des molécules mises en jeu. Exemples : changement d'état, modification de la température du système chimique, de sa pression, de son volume …
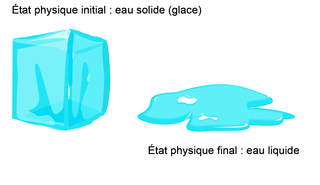 |
La température du système chimique a augmenté, provoquant la fusion du glaçon et la réduction du volume occupé par l'eau. Toutefois, il y a les mêmes molécules dans l'état initial et l'état final (molécules d'eau H2O).
• Une transformation chimique s'accompagne d'une modification des espèces chimiques présentes dans l'état initial. Les atomes présents dans les molécules de départ sont redistribués afin de former de nouvelles molécules.
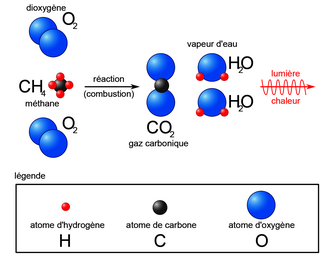 |
• On compte autant d'atomes dans l'état initial que dans l'état final. Ainsi, la masse est conservée au cours d'une réaction chimique.
II. Comment décrire une transformation chimique ?
• Pour écrire une transformation chimique, on représente deux cadres, l'un décrivant l'état initial et l'autre l'état final de la transformation. On y indique les espèces présentes (réactifs et produits) ainsi que les paramètres physiques connus. Exemple pour la transformation précédente :
| État initial | État final |
|---|---|
| Dioxygène O2(g) Méthane CH4(g) Pression atmosphérique Température : 25 °C | Dioxyde de carbone CO2(g) Vapeur d'eau H2O Pression atmosphérique Température : 2 400 °C |
© 2000-2025, Miscellane