Les solutions acido-basiques et le pH
I. Solutions acides et basiques – pH
• Une solution aqueuse contient en majorité des molécules d'eau H2O. Elle contient également les ions hydrogène H+ et les ions hydroxyde HO − en plus ou moins grande quantité. C'est la quantité de ces ions qui détermine notamment une sensation macroscopique d'acidité ou encore un caractère corrosif.
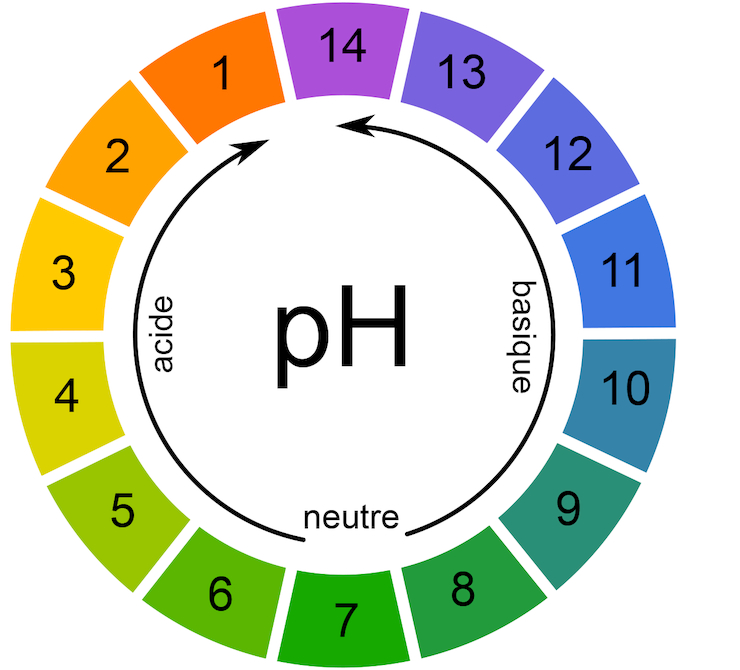
• Une solution de pH = 7 est neutre. Elle contient autant d'ions H+ que HO − .
Une solution de pH < 7 est acide. Elle contient davantage d'ions H+ que HO − .
Une solution de pH > 7 est basique. Elle contient davantage d'ions HO − que H+.
Une solution de pH < 7 est acide. Elle contient davantage d'ions H+ que HO − .
Une solution de pH > 7 est basique. Elle contient davantage d'ions HO − que H+.
• On évalue le pH d'une solution grâce au nuancier d'un papier pH (il suffit de déposer une ou deux gouttes de la solution à tester sur un morceau de bandelette). On peut le mesurer grâce à un pH-mètre.
 |
II. Effet d'une dilution sur le pH
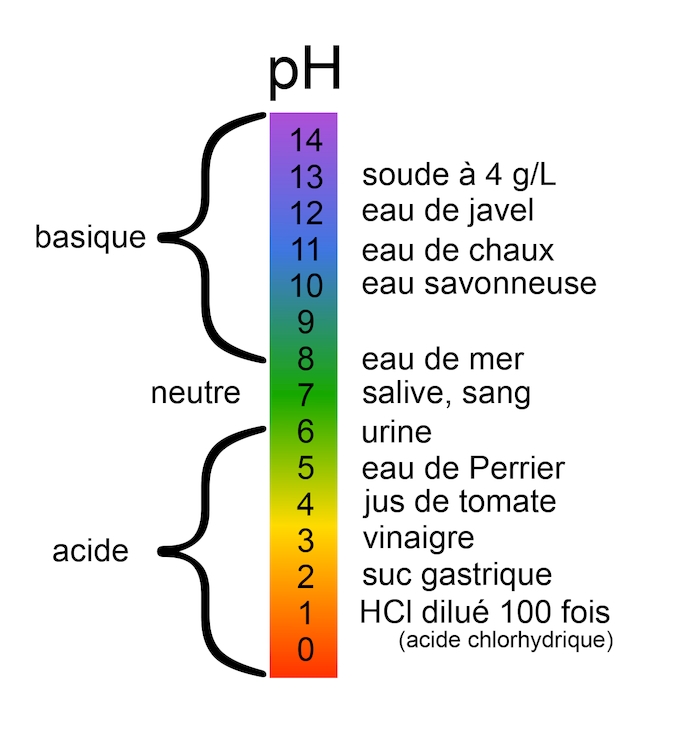
• Plus une solution est acide, plus son pH est faible. Exemple : le jus de citron est plus acide que le vinaigre : pH(citron) = 2,2 et pH(vinaigre) = 2,4. De même, plus une solution est basique, plus son pH est grand.
• Lorsqu'on dilue une solution acide, elle devient un peu moins acide et son pH se rapproche de 7. Attention : la solution ne devient pas basique, car on ne rajoute pas d'ions HO − . Lorsqu'on dilue une solution basique, son pH se rapproche également de 7.
 |
III. Sécurité
• Les solutions acides et basiques sont corrosives, elles peuvent entraîner des brûlures graves de la peau, des muqueuses et des yeux. Particulièrement les solutions concentrées.
Exemples de réactions acido-basiques
• Les espèces acides et basiques peuvent réagir entre elles pour former un mélange soit acide, soit basique, soit neutre.
• Exemples de réactions acido-basiques :
H+ (aq)+ HO − (aq) → H2O(l) ;
HCO3 − (aq) + H+ (aq) → CO2(aq) + H2O(l).
H+ (aq)+ HO − (aq) → H2O(l) ;
HCO3 − (aq) + H+ (aq) → CO2(aq) + H2O(l).
© 2000-2025, Miscellane