Description et caractérisation de la matière à l'échelle macroscopique
Fiche
Les corps purs et les mélanges sont omniprésents dans notre quotidien. Pourtant, il est parfois difficile de les distinguer ou de les identifier. Le chimiste a donc des outils qui lui permettent de connaître l'espèce chimique qu'il étudie. Il est parfois nécessaire d'en donner les caractéristiques : le pourcentage massique de l'espèce dans le mélange ou la concentration du soluté dans la solution.
I. Corps purs et mélanges
• On appelle corps pur toute substance constituée d'une seule espèce chimique. On représente le corps pur par une formule chimique.
• Un mélange est constitué de plusieurs espèces chimiques.
• Un mélange est dit homogène lorsque l'œil ne distingue pas les différents constituants. Par exemple, un café sucré est un mélange homogène. Le parfum (constitué de nombreuses huiles essentielles), l'eau salée, l'eau du robinet sont également des mélanges homogènes.
• Un mélange est dit hétérogène lorsque l'œil distingue au moins deux constituants. Par exemple, dans un soda gazeux, on distingue les bulles de gaz et le soda. Les taches d'essence dans les flaques d'eau, l'eau et le sable, le béton constitué de sable et de ciment sont des mélanges hétérogènes.
• La composition massique d'un mélange donne le pourcentage massique ou volumique de chacune des espèces qui constituent le mélange. Ainsi le pourcentage massique de l'espèce A de masse mA dans le mélange de masse m est donné par :
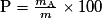 .
.
Exemple : dans un litre d'air, il y a 0,78 L de diazote et 0,21 L de dioxygène. Cela correspond à 78 % de diazote et 21 % de dioxygène.
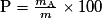 .
.Exemple : dans un litre d'air, il y a 0,78 L de diazote et 0,21 L de dioxygène. Cela correspond à 78 % de diazote et 21 % de dioxygène.
II. Identification d'espèces chimiques pures
• L'identification des corps purs peut se faire grâce aux tables des grandeurs physiques caractéristiques.
Les températures de changement d'état :
Lors d'un changement d'état, la température de fusion ou de vaporisation reste constante : c'est une caractéristique d'une espèce.Ainsi lors de la vaporisation, il suffit de mesurer, à l'aide d'un thermomètre, la température pour trouver l'espèce qui passe de l'état liquide à l'état gazeux.
Il en est de même pour la fusion, on utilise alors un banc de Kofler.
Nom des changements d'état
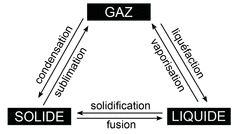 |
Exemple : la température d'ébullition de l'eau est 100 °C et sa température de fusion est 0 °C.
La masse volumique :
La masse volumique ρ d'une espèce chimique est le rapport de sa masse m et de son volume V. D'où la relation suivante :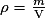
Avec m : masse en kg et V : volume en m3. Ainsi on aura ρ masse volumique en kg
 m-3.
m-3.Il est parfois utile d'exprimer la masse volumique en : g
 L-1 ou en g
L-1 ou en g  cm-3.
cm-3.Exemple : la masse volumique de l'eau est 1,000 kg
 L-1 et celle de l'air est 1,3 g
L-1 et celle de l'air est 1,3 g  L-1.
L-1.La densité :
Parfois, on utilise la densité d d'un liquide ou d'un solide qui est le rapport entre la masse volumique de l'espèce et la masse volumique de l'eau :
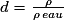 .
.
On peut également utiliser la densité d d'un gaz qui est le rapport entre la masse volumique de l'espèce et la masse volumique de l'air :
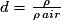 .
.
La densité d'une espèce est une grandeur sans dimension.
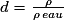 .
.On peut également utiliser la densité d d'un gaz qui est le rapport entre la masse volumique de l'espèce et la masse volumique de l'air :
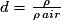 .
.La densité d'une espèce est une grandeur sans dimension.
• L'identification des corps purs peut également se faire par des tests chimiques.
L'eau :
Le sulfate de cuivre anhydre est de couleur blanche. Au contact de l'eau, il devient bleu. Il permet donc de détecter la présence d'eau.Le dioxyde de carbone :
L'eau de chaux se trouble au contact de dioxyde de carbone.Le dioxygène :
L'allumette incandescente se rallume en présence de dioxygène.Le dihydrogène :
Lorsqu'on approche une flamme de dihydrogène, on entend une détonation.
• L'identification des corps purs et des mélanges peut se faire par chromatographie sur couche mince. Celle-ci permet de séparer et d'identifier des espèces chimiques présentes dans un mélange. Les différentes substances placées sur la plaque de chromatographie sont entraînées par une phase mobile (l'éluant) qui monte par capillarité.
III. Les solutions aqueuses
• L'espèce qui est dissoute dans un solvant s'appelle le soluté. Le mélange homogène obtenu après dissolution du soluté est appelé solution. Si le solvant est l'eau, ce sera une solution aqueuse.
• La concentration massique, ou titre massique, cm, correspond à la masse de soluté dissous dans un litre de solution.
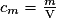
Avec cm : concentration massique en g L-1, m : masse du soluté en grammes (g) et V : volume de la solution en litres (L).
L-1, m : masse du soluté en grammes (g) et V : volume de la solution en litres (L).
Attention à ne pas confondre la masse volumique qui est le rapport entre la masse d'une substance et le volume de la substance avec la concentration massique qui est le rapport entre la masse de la substance et le volume de la solution.
On ne peut pas dissoudre n'importe quelle masse de soluté dans un solvant. Il existe une masse maximale qui correspond à la masse limite de soluté au-delà de laquelle le soluté ne sera plus dissous. La solution est alors dite saturée.
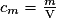
Avec cm : concentration massique en g
 L-1, m : masse du soluté en grammes (g) et V : volume de la solution en litres (L).
L-1, m : masse du soluté en grammes (g) et V : volume de la solution en litres (L).Attention à ne pas confondre la masse volumique qui est le rapport entre la masse d'une substance et le volume de la substance avec la concentration massique qui est le rapport entre la masse de la substance et le volume de la solution.
On ne peut pas dissoudre n'importe quelle masse de soluté dans un solvant. Il existe une masse maximale qui correspond à la masse limite de soluté au-delà de laquelle le soluté ne sera plus dissous. La solution est alors dite saturée.
• Une solution peut être préparée par dissolution ou par dilution.
Préparation par dissolution :
• Pour préparer une solution aqueuse de concentration massique cm, il faut prélever une masse m de l'espèce chimique à dissoudre dans une fiole jaugée. La masse m est calculée avec la relation suivante :
m = cm × V.
m = cm × V.
• Une fois la masse pesée, il faudra rajouter de l'eau distillée qui est le solvant de la solution.
Préparation par dilution :
• Lors de la dilution de la solution mère, on obtient une solution fille. Au cours d'une dilution, la masse de soluté m prélevé dans la solution mère est inchangée.
Pour réaliser une solution par dilution, on prélève un volume Vmère prélevé d'une solution mère de concentration cmère. Après ajout d'eau distillée dans la fiole jaugée, on obtient une solution cfille de concentration et de volume Vfille, telle que :
cmère Vmère prélevé = cfille
Vmère prélevé = cfille Vfille.
Vfille.
Où les concentrations sont en mol L-1 et les volumes sont en L.
L-1 et les volumes sont en L.
Pour réaliser une solution par dilution, on prélève un volume Vmère prélevé d'une solution mère de concentration cmère. Après ajout d'eau distillée dans la fiole jaugée, on obtient une solution cfille de concentration et de volume Vfille, telle que :
cmère
 Vmère prélevé = cfille
Vmère prélevé = cfille Vfille.
Vfille.Où les concentrations sont en mol
 L-1 et les volumes sont en L.
L-1 et les volumes sont en L.IV. Dosage par étalonnage
• Pour déterminer la concentration massique inconnue d'une espèce, on peut réaliser un dosage par étalonnage. Un dosage par étalonnage consiste à situer par un encadrement la concentration massique de l'espèce en comparant sa couleur à celles des solutions étalons d'une échelle de teinte.
• Si la solution n'est pas colorée, on peut construire une courbe étalon à partir de différentes masses volumiques de la solution prise à différentes concentrations. On obtiendra la droite de la masse volumique en fonction de la concentration. En mesurant la masse volumique de la solution inconnue, puis en la comparant au graphique, on détermine également la concentration inconnue.
À retenir :
Savoir distinguer corps pur et mélanges homogènes ou hétérogènes.
Connaître des exemples courants de corps purs et de mélanges.
Savoir comment identifier les espèces chimiques par des mesures physiques (température de changement d'état, sa masse volumique) ou des tests chimiques.
Connaître des tests chimiques de présence d'eau, de dihydrogène, de dioxygène, de dioxyde de carbone.
Connaître la valeur de la masse volumique de l'eau liquide et savoir la comparer à celles d'autres corps purs à partir de données expérimentales.
Savoir calculer la composition massique d'un mélange.
Connaître la composition approchée de l'air et l'ordre de grandeur de la valeur de sa masse volumique.
Savoir distinguer solvant et soluté.
Savoir calculer la concentration en masse et la concentration maximale d'un soluté.
Savoir distinguer la concentration en masse d'un soluté dans une solution et la masse volumique d'un échantillon.
Savoir déterminer la valeur d'une concentration en masse et d'une concentration maximale à partir d'un dosage par étalonnage.
Savoir distinguer corps pur et mélanges homogènes ou hétérogènes.
Connaître des exemples courants de corps purs et de mélanges.
Savoir comment identifier les espèces chimiques par des mesures physiques (température de changement d'état, sa masse volumique) ou des tests chimiques.
Connaître des tests chimiques de présence d'eau, de dihydrogène, de dioxygène, de dioxyde de carbone.
Connaître la valeur de la masse volumique de l'eau liquide et savoir la comparer à celles d'autres corps purs à partir de données expérimentales.
Savoir calculer la composition massique d'un mélange.
Connaître la composition approchée de l'air et l'ordre de grandeur de la valeur de sa masse volumique.
Savoir distinguer solvant et soluté.
Savoir calculer la concentration en masse et la concentration maximale d'un soluté.
Savoir distinguer la concentration en masse d'un soluté dans une solution et la masse volumique d'un échantillon.
Savoir déterminer la valeur d'une concentration en masse et d'une concentration maximale à partir d'un dosage par étalonnage.
© 2000-2025, Miscellane