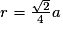Des édifices ordonnés : les cristaux
Fiche
L'objectif de cette partie est d'appréhender une forme particulière d'organisation de la matière : l'état cristallin. Les connaissances sur l'état cristallin sont utilisées en géologie, avec l'étude des minéraux et des roches, mais aussi en biologie. Il s'agit d'étudier quelques exemples d'organisations cristallines simples et de comprendre comment cette organisation détermine les propriétés macroscopiques de la matière.
I. L'état cristallin de la matière : exemple du NaCl
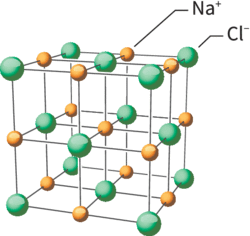
• Le sel ou chlorure de sodium, noté NaCl, se présente à l'œil nu sous forme d'une poudre blanche, comme le sel fin de table. Des échantillons de plus grande taille peuvent se présenter sous forme de cristaux de forme cubique à faces lisses. L'étude de la structure microscopique du NaCl met en évidence que les différents ions constituant ce solide sont agencés de manière régulière dans l'espace. La plus petite unité de cet agencement régulier est appelée « maille ». Cette maille se répète dans l'espace, formant un réseau cristallin. L'étude des caractéristiques de la maille de chaque cristal permet de définir certaines caractéristiques de ce cristal.
Le chlorure de sodium ou NaCl
| État macroscopique : visible à l'œil nu Cristal de sel (longueur et largeur : quelques cm) | Représentation en 3D de la structure cristalline du sel NaCl | ||
|
|
II. Les réseaux cristallins cubiques
• Les cristaux les plus simples sont les réseaux cristallins cubiques, dont la maille peut être décrite à partir de la géométrie du cube.
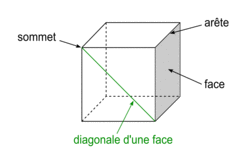
Géométrie du cube
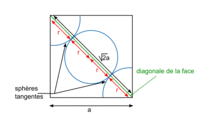
| Un cube est un solide dont toutes les faces sont carrées. Un cube comporte 6 faces, 12 arêtes et 8 sommets. Les faces opposées sont parallèles. Les faces adjacentes sont perpendiculaires. Les arêtes ont une même longueur notée a. Deux arêtes ayant une extrémité commune sont orthogonales. Les diagonales du cube sont concourantes en un point unique, appelé centre du cube. La diagonale d'une face vaut 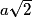 . .La grande diagonale du cube (qui passe par le centre du cube) vaut 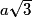 . .La surface de chaque face est égale à a2. Le volume du cube est égal à a3. |
• On distingue différents réseaux cubiques selon la position des entités dans la maille, en particulier :
- le réseau cubique simple ;
- le réseau cubique à faces centrées.
Représentation d'un réseau cubique
 |
• Pour chaque type de réseau, deux grandeurs caractéristiques du cristal peuvent être calculées : la masse volumique et la compacité. La masse volumique d'un cristal est le rapport de la masse du cristal par son volume. Au niveau d'une maille, la masse volumique est le rapport de la masse des entités chimiques d'une maille par le volume de cette maille. L'unité couramment utilisée de la masse volumique est le g.cm−3. La masse volumique dépend du nombre d'entités chimiques par maille, de la masse molaire des entités chimiques et des dimensions de la maille.
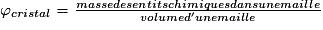
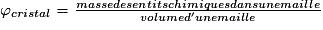
• La compacité d'un cristal est le rapport du volume total des sphères des entités chimiques d'une maille par le volume de cette maille. Il s'agit d'une grandeur sans unité. La compacité représente le taux de remplissage de la maille par les sphères des entités chimiques.
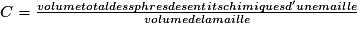
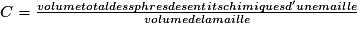
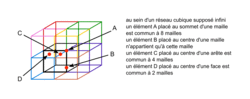
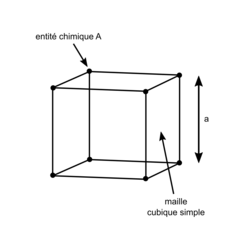
• La structure cubique simple se caractérise par la présence d'une entité chimique (atomes ou ions) située à chaque sommet du cube : il s'agit de la structure la plus simple existante, mais elle est très peu présente dans la nature.
Réseau cubique simple
| Représentation de la maille en perspective cavalière |
| |
| Nombre d'entités chimiques A par maille | 1 entité chimique A à chaque sommet, soit 8 entités chimiques A par maille (car 8 sommets) ; or une entité chimique A située au sommet du cube est commune à 8 mailles. → 1 entité chimique A par maille. | |
| Formule stœchiométrique | A1 = A. | |
Masse volumique 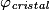 | 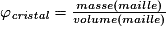 . .Or  avec M(A) : masse molaire de l'entité chimique A (g.mol−1) et Na : nombre d'Avogadro ( Na = 6,02.1023 mol−1) et volume (maille) a3 Donc 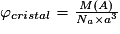 . . | |
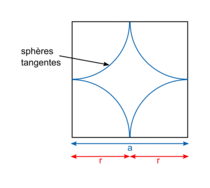
| Compacité | Calcul des rayons des sphères des entités chimiques A dans le cas de sphères tangentes :
| |
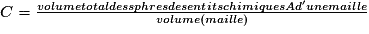 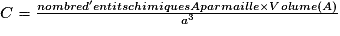 or 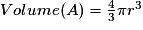 avec r = rayon de la sphère de l'entité chimique A 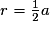 et le nombre d'entités chimiques A par maille est 1, et le nombre d'entités chimiques A par maille est 1,on a donc 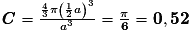 . .La structure cubique simple, très rare, présente une faible compacité. |
• La structure cubique centrée se caractérise par la présence d'une entité chimique (atomes ou ions) située à chaque sommet du cube et d'une entité chimique située au centre du cube. Elle n'est pas étudiée ici et ne doit pas être confondue avec la structure cubique à faces centrées étudiée plus loin.
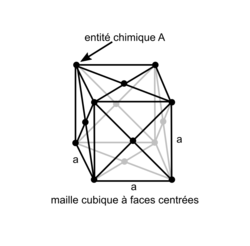
• La structure cubique à faces centrées, appelée « cfc », se caractérise par la présence d'une entité chimique (atomes ou ions) à chaque sommet du cube et au milieu de chaque face.
Réseau cubique à faces centrées
| Représentation de la maille en perspective cavalière |
| |
| Nombre entités chimiques A par maille |
| |
| Formule stœchiométrique | A4 | |
| Masse volumique |  avec M(A) : masse molaire de l'entité chimique A (g.mol−1) et Na : nombre d'Avogadro (Na = 6,02.1023 mol−1) et volume (maille) = a3 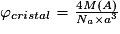 . . | |
| Compacité | Calcul des rayons des sphères des entités chimiques A dans le cas de sphères tangentes :
| |
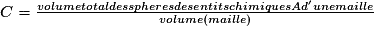 or 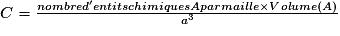 avec 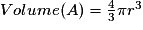 avec avec 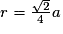 et le nombre d'entités chimiques A par maille est de 4. et le nombre d'entités chimiques A par maille est de 4.On a donc 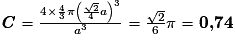 . .La compacité de réseau cubique à face centrée est maximale parmi les réseaux cristallins. |
• La maille cubique à faces centrées présente des sites où peuvent se loger des entités chimiques supplémentaires, de plus petite taille que celles formant la maille cubique. Par exemple, dans le cas du NaCl, les ions chlorure forment une maille cubique à faces centrées tandis que les ions sodium, de plus petite taille, sont situés au centre de chaque arête et au centre de la maille.
Caractéristiques du cristal de NaCl
| Structure cristalline |
| |
| Formule stœchiométrique | Na4Cl4 | |
| Masse molaire | 58,4 g.mol−1 | |
| a | 56,4 nm (56,4.10−9 m) | |
| Masse volumique (à 20 °C) | 2,16 g.cm−3 | |
| Compacité | c = 0,64 |
• Ainsi, de manière générale, une structure cristalline est définie par une maille élémentaire qui se répète périodiquement dans l'espace. On distingue au total 7 grands types de réseaux cristallins différents. Un cristal est donc défini par la forme géométrique de la maille, la nature des entités chimiques (atomes ou ions) et leur position géométrique dans cette maille. Lorsqu'un cristal se forme sans entraves, il prend au niveau macroscopique une forme polyédrique délimitée par des surfaces planes, en relation avec la nature de son réseau cristallin. Si la formation du cristal ne s'effectue pas librement, le cristal présente alors une structure macroscopique indépendante de la nature de son réseau cristallin. Ainsi, la structure microscopique du cristal conditionne certaines de ses propriétés macroscopiques, dont sa masse volumique.Exercice n°1Exercice n°2
III. La matière cristallisée
• Un composé de formule chimique donnée peut cristalliser sous différents types de structures du fait des arrangements variés des entités chimiques le constituant, selon les conditions de pression et de température existant lors de sa cristallisation. Par exemple, la silice (SiO2), minéral abondant des roches de la croûte terrestre, cristallise sous forme de quartz selon un système cristallin hexagonal. La cristallisation de la silice à une pression très élevée forme de la coésite selon un autre système cristallin, appelé « monoclinique pseudohexagonal ». Ainsi, un même minéral, caractérisé par sa formule chimique, peut présenter des structures cristallines différentes et donc des propriétés macroscopiques différentes. Les minéraux se caractérisent donc par leur composition chimique et leur organisation cristalline.
• Une roche est un matériau formé par l'assemblage d'unités élémentaires, les minéraux, qui constituent le globe terrestre. Une roche peut être parfois formée d'un seul minéral, mais plus fréquemment d'une association de différents minéraux.
• Des structures cristallines existent aussi dans les êtres vivants. Par exemple, un minéral cristallisé, le carbonate de calcium (CaCO3), est un des constituants majeurs des coquilles de différents animaux, du squelette des vertébrés ou encore du corail.
Maille, cristal, minéral et roches : des différences d'échelle et d'organisation
| + : mm à km | mm à m | − : 10−12 m |
| Roche : matériau formé par l'assemblage de minéraux. | |
| Minéral : espèce chimique naturelle sous forme cristallisée ou amorphe. Cristal : solide dont les différents éléments constitutifs sont arrangés de manière régulière selon un motif de la base, la maille élémentaire. | ||||
| Maille : plus petite unité d'un réseau cristallin. |
IV. La matière non cristallisée
• Un composé chimique, qui forme un cristal dans certaines conditions de pression et de température, peut se solidifier sans former de réseaux cristallins dans des conditions de pression et de température différentes. L'empilement des entités chimiques se fait alors sans ordre géométrique, formant un solide qualifié d'« amorphe » (sans forme) et appelé « verre ».
• Lors de la formation de roches magmatiques volcaniques, le magma formé en profondeur remonte très rapidement et donne une lave à la surface terrestre. Cette lave se refroidit brutalement. Lors de ce refroidissement, certains minéraux ont le temps de cristalliser, mais une partie plus ou moins importante de la lave se solidifie rapidement à faible température sans ordre géométrique, formant ainsi de la matière non cristallisée, ou verre.
Comparaison de deux roches, l'une entièrement cristallisée, l'autre riche en matière non cristallisée
| Une roche entièrement cristallisée : le granite | Une roche non entièrement cristallisée : la rhyolite | ||
|
| ||
| Roche magmatique plutonique issue du refroidissement lent dans la croûte terrestre d'un magma riche en silice à une température d'environ 900 °C. Le granite est une roche composée de minéraux entièrement cristallisés, de taille variable. | Roche magmatique volcanique issue du refroidissement rapidement en surface d'un magma riche en silice, à la température de la surface de la Terre. Une majeure partie des minéraux n'ont pas eu le temps de cristalliser. Du verre, c'est-à-dire de la matière non cristallisée, s'est formé en quantité importante. Ce verre contient des cristaux de petite taille. |
© 2000-2025, Miscellane


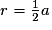 .
.
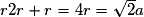 donc
donc